
【题目】取Na2CO3和NaHCO3的混合粉末样品22.1g,将其加热到质量不再改变,冷却后称固体质量为15.9g。则原混合物中Na2CO3的质量为
A. 4.2g B. 5.3g C. 8.4 g D. 10.6 g
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜性质并测定其晶体中结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤、得M固体。为了探究M的组成,进行如下实验:
①取一定量M固体分成两份;
②在一份固体中加入稀硫酸,产生刺激性气味的气体X,将气体X通入溴水中,溴水褪色;溶液变成蓝色并有红色固体生成。
③在另一份固体中加入浓烧碱溶液,共热,产生的气体Y通入甲基橙溶液中,溶液变黄色。
(1)X的化学式是______________。
(2)经测定,M中阳离子、阴离子个数之比为2∶1。写出M与稀硫酸反应的化学方程式:____________。
实验(二):探究硫酸铜晶体的热稳定性。
他们取少量硫酸铜晶体进行实验,装置如图所示。
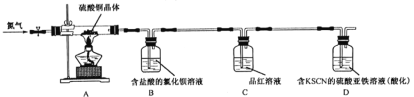
观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。
(3)B中用盐酸酸化的目的是______________;C中现象是__________________________________。
(4)D中有单质参加反应的离子方程式:________________________________________________。
实验(三):测定硫酸铜晶体中结晶水含量。
取wg硫酸铜晶体(CuSO4·xH2O)配制成250mL溶液,取20.00mL所配制溶液用cmol·L-1EDTA(简化为Na4Y)溶液滴定至终点,消耗EDTA滴定液休积为VmL。(滴定反应:Cu2++Y4-=CuY2-)
(5)x=_____________________(用代数式表示)。
(6)下列情况会使测得x值偏大的是______________(填字母)。
a.样品失去部分结晶水 b.滴定管未用EDTA溶液润洗
c.开始读数时滴定管尖嘴有气泡(终点时尖嘴无气泡) d.滴定终点时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 已知:H2(g)+![]() O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1 , 则H2的燃烧热为﹣285.8 kJmol﹣1
O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1 , 则H2的燃烧热为﹣285.8 kJmol﹣1
B. 已知:S(g)+O2(g)═SO2(g)△H1=﹣Q1;S(s)+O2(g)═SO2(g)△H2=﹣Q2 , 则Q1<Q2
C. 已知:![]() H2SO4(浓)+NaOH(aq)═
H2SO4(浓)+NaOH(aq)═![]() Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3H2O(aq)═CH3COONH4(aq)+H2O(l)△H2 , 则有|△H1|<|△H2|
Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3H2O(aq)═CH3COONH4(aq)+H2O(l)△H2 , 则有|△H1|<|△H2|
D. 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJmol﹣1
CO(g)+![]() O2(g)═CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)═CO2(g)△H=﹣283.0 kJmol﹣1
C(石墨)+O2(g)═CO2(g)△H=﹣393.5 kJmol﹣1
则4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1641.0 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化: CH4(g)+1/2O2(g) ![]() CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
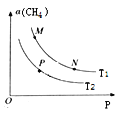
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_____________。
②M、N两点的H2的物质的量浓度c(M)____c(N)(填“>”“<”或“=”)。
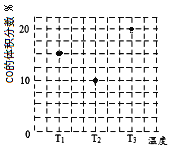
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
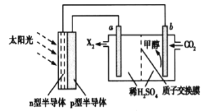
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na2O2与水反应:____________。
(2)Al2O3溶于NaOH溶液:______________。
(3)将FeCl3饱和溶液滴入沸水中制备氢氧化铁胶体:____________。
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:
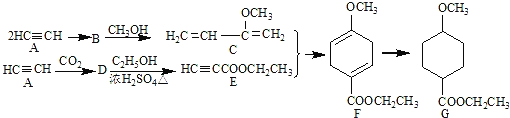
(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1mol G完全燃烧生成8mol H2O
d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
① pH值由大到小的顺序是___________________(用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________(用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。己知该温度下AgCl的Ksp =l.0×l0-10,忽略溶液的体积变化,请计算:
① 完全沉淀后,溶液中c(Ag+)=_____________。
② 完全沉淀后,溶液的pH=____________。
(3)弱酸及其盐在水中存在多种平衡关系。己知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
① 己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________。
② 向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1 Fe3+和0.26 mol·L-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5 mol·L-1 ]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2 = 2.6×l0-19;KspFe(OH)3 = 4×l0-38]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com