
【题目】写出以下反应的化学方程式:
(1)Na2O2与水反应:____________。
(2)Al2O3溶于NaOH溶液:______________。
(3)将FeCl3饱和溶液滴入沸水中制备氢氧化铁胶体:____________。
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝:_________________。
【答案】2Na2O2+2H2O=4NaOH +O2↑ Al2O3 +2NaOH= 2NaAlO2 +H2O FeCl3+3H2O ![]() Fe(OH)3 (胶体)+3HCl Al2(SO4)3+6NH3·H2O= 2Al(OH)3 ↓+3(NH4)2SO4
Fe(OH)3 (胶体)+3HCl Al2(SO4)3+6NH3·H2O= 2Al(OH)3 ↓+3(NH4)2SO4
【解析】
(1)Na2O2与水反应产生氢氧化钠和氧气,反应方程式为2Na2O2 + 2H2O=4NaOH + O2↑;
(2)Al2O3是两性氧化物,与NaOH溶液反应产生偏铝酸钠和水,反应的化学方程式是Al2O3+2NaOH=2NaAlO2+H2O;
(3)将FeCl3饱和溶液滴入沸水中加热止液体呈红褐色,就制备得到氢氧化铁胶体,反应的化学方程式是:FeCl3+3H2O ![]() Fe(OH)3 (胶体)+3HCl;
Fe(OH)3 (胶体)+3HCl;
(4)向Al2(SO4)3溶液中滴加氨水,二者发生复分解反应,产生氢氧化铝沉淀和硫酸铵,反应的化学方程式是:Al2(SO4)3+6NH3·H2O=2Al(OH)3 ↓+3(NH4)2SO4。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
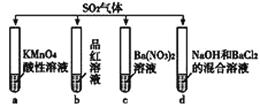
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下是碳和碳的化合物的转化关系:
![]()
其各步转化的基本反应类型从左到右依次是( )
A. 化合、分解、置换、复分解 B. 置换、化合、复分解、分解
C. 复分解、化合、分解、置换 D. 分解、置换、化合、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
下列说法不正确的是
A. 第②步过滤出的滤渣是泥沙
B. 在第④步中不能用KOH替代NaOH
C. 第⑤步加入Na2CO3溶液的目的是除去Ba2+和Ca2+
D. 第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Na2CO3和NaHCO3的混合粉末样品22.1g,将其加热到质量不再改变,冷却后称固体质量为15.9g。则原混合物中Na2CO3的质量为
A. 4.2g B. 5.3g C. 8.4 g D. 10.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Fe(CN)6]3可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是

A. 电解时阳极反应式为[Fe(CN)6]4e![]() [Fe(CN)6]3
[Fe(CN)6]3
B. 电解时阴极反应式为2HCO3-+2e![]() H2↑+2CO32-
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 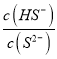 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
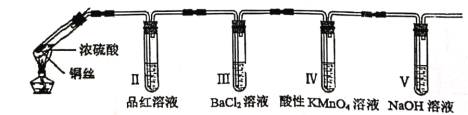
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com