
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
下列说法不正确的是
A. 第②步过滤出的滤渣是泥沙
B. 在第④步中不能用KOH替代NaOH
C. 第⑤步加入Na2CO3溶液的目的是除去Ba2+和Ca2+
D. 第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、Na2CO3、BaCl2
【答案】D
【解析】
由流程可知,粗盐溶解后过滤可除去泥沙,③加氯化钡可除去硫酸根离子,④中加NaOH除去镁离子,⑤中加碳酸钠可除去钡离子、钙离子,过滤后溶液主要为氯化钠、氢氧化钠和碳酸钠,⑦中加盐酸,反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,以此解答该题。
由流程可知,粗盐溶解后②步过滤除去泥沙,③加氯化钡可除去SO42-离子,④中加NaOH除去Mg2+,⑤中加碳酸钠可除去Ba2+、Ca2+,过滤后溶液主要为NaCl、NaOH和Na2CO3,⑦中加盐酸,NaOH和Na2CO3与HCl反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,A.由分析可知第②步过滤出的滤渣是泥沙,A正确;
B. 在第④步中若用KOH替代NaOH,就会在溶液中引入杂质离子K+,因此不能使用KOH,B正确;
C.第⑤步加入Na2CO3溶液,发生反应:Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,因此能达到除去Ba2+和Ca2+的目的,C正确;
D.若第③步加入NaOH可除去Mg2+,第④步加Na2CO3可除去Ca2+,第⑤步添加BaCl2溶液可除去SO42-,但这样的顺序,最后加入BaCl2溶液,就又引入了杂质Ba2+离子,加入盐酸不能除去,所以BaCl2溶液必须在Na2CO3溶液之前加入,可以在NaOH溶液之前加入,也可以在NaOH溶液之后加入,D错误;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是( )
A. 苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B. 从苯的凯库勒式( )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C. 在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D. 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:

(1)为了检查整套装置的气密性,某同学将导气管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是_______________。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入______,目的是______,并向装置C中试管里加入适量稀溴水。
(3)为了使反应在75 ℃左右进行,常用的方法是_______________________________。
(4)与装置A中大试管相连接的长玻璃管的作用是______,装置B的作用是______。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是______,装置A、C中发生反应的化学方程式分别为_________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
___________________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的化学方程式:___________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
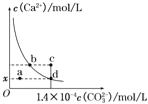
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na2O2与水反应:____________。
(2)Al2O3溶于NaOH溶液:______________。
(3)将FeCl3饱和溶液滴入沸水中制备氢氧化铁胶体:____________。
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表,下列说法不正确的是
M(g)+N(s),所得实验数据如下表,下列说法不正确的是
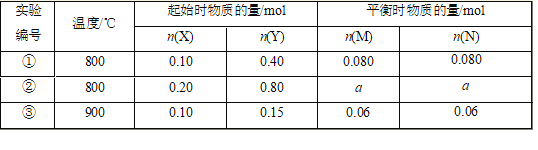
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com