
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
___________________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的化学方程式:___________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
【答案】BC 2NaCl(熔融)![]() 2Na+Cl2↑ 提高溴的富集程度 Br2+SO2+2H2O=2HBr+H2SO4 冷凝管 甲 深红棕色或红棕色 吸收尾气
2Na+Cl2↑ 提高溴的富集程度 Br2+SO2+2H2O=2HBr+H2SO4 冷凝管 甲 深红棕色或红棕色 吸收尾气
【解析】
海水淡化得到氯化钠,电解氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr和硫酸的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,据此解答。
(1)要先除SO42-离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,然后过滤即可,最后加盐酸除去过量的氢氧根离子、碳酸根离子,则:
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液,溶液中过量的钡离子不能除去,故A错误;
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故B正确;
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,故C正确;
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液,溶液中过量的钡离子不能除去,故D错误;
故答案为BC;
(2)制备钠单质的方法之一是将熔融NaCl进行电解,电解的化学方程式为2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,便于富集溴元素,步骤Ⅱ中发生反应是二氧化硫还原溴单质,发生反应的方程式为Br2+SO2+2H2O=2HBr+H2SO4;
(4)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,冷凝水应从下端进,即从乙进,冷却水的出口为甲;
②控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色或红棕色的液态溴单质;
③进入D装置的物质为溴蒸汽,溴蒸汽有毒,避免污染环境,最后进行尾气吸收。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及金属状态存在。一种从阳极泥中提取Se和Te的工艺流程见下:
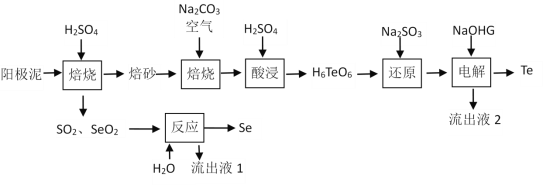
已知:碲酸钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。
回答下列问题:
(1)阳极泥在600 K左右加入一定浓度H2SO4“焙烧”时,单质Te转化为TeO2的化学方程式为___________________________________________。
(2) “焙砂”与碳酸钠充分混合,干燥后通空气氧化物料,每生成1 mol碲酸钠,则需要的氧化剂O2至少为_______mol;生成的碲酸钠不水浸,而采取“酸浸”的原因是______________________________________。
(3) “反应”时的化学方程式为_________________________________________________。
(4)“还原”中的反应生成物为TeO2,检验反应后是否有反应物Na2SO3过量的实验操作方法为________________________________________________________。
(5)已知“电解”时使用石墨电极,阳极产物与阴极产物的物质的量之比为______________。
(6)工艺路线中可以循环利用的物质有_____________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃可以由相应的烯烃经催化加氢得到,有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,分别可以而且只能由一种相应的烯烃催化加氢得到,推断并写出A、B1、B2、B3的结构简式为:A________,B1______________,B2__________,B3_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下是碳和碳的化合物的转化关系:
![]()
其各步转化的基本反应类型从左到右依次是( )
A. 化合、分解、置换、复分解 B. 置换、化合、复分解、分解
C. 复分解、化合、分解、置换 D. 分解、置换、化合、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+ O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 |
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
下列说法不正确的是
A. 第②步过滤出的滤渣是泥沙
B. 在第④步中不能用KOH替代NaOH
C. 第⑤步加入Na2CO3溶液的目的是除去Ba2+和Ca2+
D. 第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Fe(CN)6]3可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是

A. 电解时阳极反应式为[Fe(CN)6]4e![]() [Fe(CN)6]3
[Fe(CN)6]3
B. 电解时阴极反应式为2HCO3-+2e![]() H2↑+2CO32-
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是

A. 对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
B. 对于反应2A(g)+B(g)![]() C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C. 该图象表示的化学方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH < 0,y可以表示Y的百分含量
2Z(g) ΔH < 0,y可以表示Y的百分含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com