
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表,下列说法不正确的是
M(g)+N(s),所得实验数据如下表,下列说法不正确的是
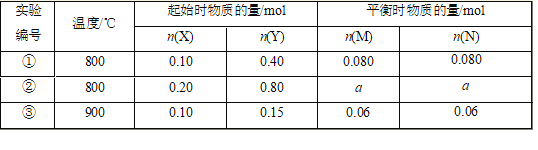
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
【答案】A
【解析】①③相比,Y的浓度不同、温度不同,Y的量减少或升高温度平衡逆向移动,均可使平衡时M的物质的量减小,则不能判断正反应是否为放热反应,A错误;实验①中,生成M为0.08 mol,则X的变化量为0.08 mol, 5min达平衡达平衡,用X表示的平均反应速率v(X)= (0.08÷1)/5=0.016 mol/(L·min);B正确;①②中温度相同,则K相同,由①可以知道:
![]()
![]()
开始 0.1 0.4 0
转化 0.080.08 0.08
平衡 0.02 0.32 0.08
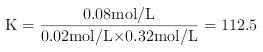 ,C正确;①②温度相同、体积相同,②中物质的量为①的2倍,若平衡不移动,
,C正确;①②温度相同、体积相同,②中物质的量为①的2倍,若平衡不移动,![]() ,但是压强增大平衡正向移动,则a大于0.16,D正确;正确选项 A。
,但是压强增大平衡正向移动,则a大于0.16,D正确;正确选项 A。


科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
下列说法不正确的是
A. 第②步过滤出的滤渣是泥沙
B. 在第④步中不能用KOH替代NaOH
C. 第⑤步加入Na2CO3溶液的目的是除去Ba2+和Ca2+
D. 第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 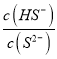 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是

A. 对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
B. 对于反应2A(g)+B(g)![]() C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C. 该图象表示的化学方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH < 0,y可以表示Y的百分含量
2Z(g) ΔH < 0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
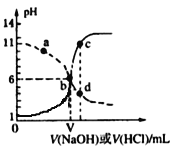
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+) > c(Cl-) > c(OH-) > c(BOH)
C. c、d两点溶液混合后微粒之间存在关系:c(H+) = c(OH-) + c(BOH)
D. b点时两种溶液中水的电离程度相同,且V=20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
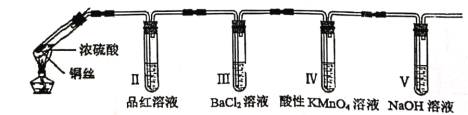
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_____________(填序号)。
(2)H2的燃烧热为_____________,C的燃烧热为_____________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为______________,其热化学方程式为_______________________。
(5)在某温度时,测得0.01 molL-1的NaOH溶液的pH为11。该温度下,水的离子积常数Kw =________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
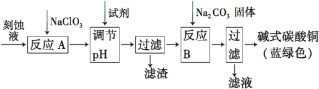
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com