
【题目】25℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
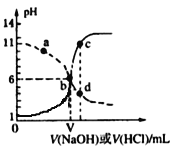
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+) > c(Cl-) > c(OH-) > c(BOH)
C. c、d两点溶液混合后微粒之间存在关系:c(H+) = c(OH-) + c(BOH)
D. b点时两种溶液中水的电离程度相同,且V=20
【答案】C
【解析】根据图象分析,虚线图象是HCl滴定BOH溶液,实线图象是NaOH滴定HA溶液,HA溶液与BOH溶液均为0.1 mol·L-1,根据起始状态判断,HA溶液的pH为1,则HA完全电离,是强酸;BOH起始时溶液的pH为11,不完全电离,则BOH是弱碱; HA是强酸,BOH是弱碱,A错误;a点所在曲线是![]() 的HCl滴定
的HCl滴定![]() 的BOH,根据溶液中的电荷守恒:
的BOH,根据溶液中的电荷守恒:![]() ,溶液为碱性,大量存在BOH,溶液中
,溶液为碱性,大量存在BOH,溶液中![]() ,则
,则![]() ,反应产物为BCl且剩余大量的BOH,溶液中
,反应产物为BCl且剩余大量的BOH,溶液中![]() ,B错误;c点对于NaOH滴定HA溶液时,溶液此时为碱性,可判断此时溶液的组分为NaOH过量和NaA;d点对于HCl滴定BOH溶液时,溶液此时为酸性,可判断溶液的组分为BCl和过量的HCl,因为c、d点时滴加NaOH或者HCl的量相同,则在c、d点时,平衡时NaOH和NaA,BCl和HCl的物料比相同,记为
,B错误;c点对于NaOH滴定HA溶液时,溶液此时为碱性,可判断此时溶液的组分为NaOH过量和NaA;d点对于HCl滴定BOH溶液时,溶液此时为酸性,可判断溶液的组分为BCl和过量的HCl,因为c、d点时滴加NaOH或者HCl的量相同,则在c、d点时,平衡时NaOH和NaA,BCl和HCl的物料比相同,记为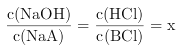 ,根据反应关系和初始条件关系,可以知道c、d点溶液混合之后发生反应,最终溶液的组分关系为x份
,根据反应关系和初始条件关系,可以知道c、d点溶液混合之后发生反应,最终溶液的组分关系为x份![]() 、1份
、1份![]() 和1份
和1份![]() ,根据电荷守恒,c(Na+)+c(H+)+c(B+)=c(OH-)+c(A-)+c(Cl-),根据物料守恒: c(A-)= c(B+)+ c(BOH),由于c(Na+)= c(Cl-),则有c(H+) = c(OH-) + c(BOH);D正确;正确选项C。
,根据电荷守恒,c(Na+)+c(H+)+c(B+)=c(OH-)+c(A-)+c(Cl-),根据物料守恒: c(A-)= c(B+)+ c(BOH),由于c(Na+)= c(Cl-),则有c(H+) = c(OH-) + c(BOH);D正确;正确选项C。


科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
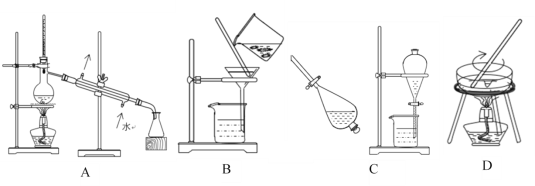
请根据混合物分离或提纯的原理,回答下列问题:
①以上四种化学实验操作的名称依次是:______、______、______、_______。
②分离CCl4(沸点:76.75℃)和苯(沸点:110.6℃)的混合物(互溶)应选用________;(填装置字母)
③在使用C进行化学实验操作前,应先____________。
(2)实验室现需要480ml 0.10mol/L的NaOH溶液,就配置该溶液回答下列问题:
①用托盘天平称量NaOH固体___________g。
②称量必需迅速,原因是__________________________________________。
③将配置好的溶液准确取出480ml后,将剩余溶液取出加水稀释至100ml保存于试剂瓶中,请给它贴上标签,标签上的内容是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30% H2SO4。下图是处于工作状态的铅蓄电池示意图,若两电极的质量都增加且a极增加得更多。下列说法正确的是

A. a为铅蓄电池的正极
B. b电极发生的反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
C. 该铅蓄电池正在充电
D. 工作一段时间后,溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表,下列说法不正确的是
M(g)+N(s),所得实验数据如下表,下列说法不正确的是
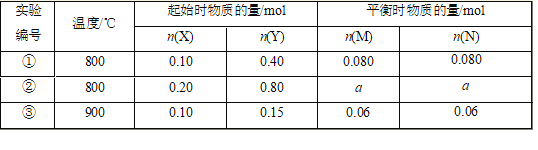
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LH2O中含有共价数目为2NA
B. NA个氧气分子与NA个氢分子的质量比为8:1
C. 8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D. 4.6g金属钠与500mL 0.2mol/L的盐酸充分反应,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究橄榄石(仅含三种短周期元素)的组成和性质。
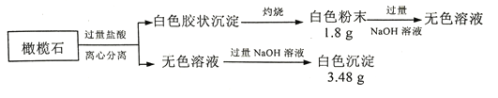
(1)橄榄石的组成元素是O和____、____(填元素符号),化学式为__________。
(2)写出白色粉末A的一种用途:__________________________。
(3)白色粉末A溶于NaOH溶液的离子方程式是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,则定蛋壳中钙含量操作步骤如图12所示:
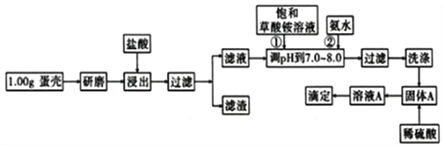
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是____________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是__________________。
(3)洗涤最好选用_____(填“冰水”或“0.1mol/L草酸铵溶液”),其目的是____________。
(4))滴定操是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸台定量关系,可间接求出钙的含量
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化
步骤3:用00190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mL.
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V2=19.98 |
4 | 0.0190 | V4=20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为_______________________。
②滴定终点的现象是_________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com