
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,则定蛋壳中钙含量操作步骤如图12所示:
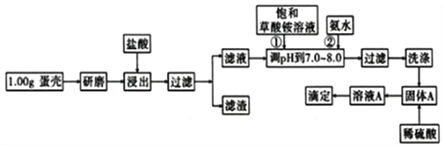
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是____________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是__________________。
(3)洗涤最好选用_____(填“冰水”或“0.1mol/L草酸铵溶液”),其目的是____________。
(4))滴定操是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸台定量关系,可间接求出钙的含量
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化
步骤3:用00190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mL.
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V2=19.98 |
4 | 0.0190 | V4=20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为_______________________。
②滴定终点的现象是_________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)
【答案】 SiO2 保持较大的C2O42-浓度,使Ca2+沉淀完全 0.1mol/L草酸铵溶液 减少草酸钙固体的溶解 2MnO4-+6H++5H2C2O4==2Mn2++10CO2↑+8H2O 当加入最后1滴高锰酸钾溶液时,溶液颜色由无色变成紫红色,且30s内不褪色 95.00 >
【解析】(1). SiO2不与除HF外所有酸反应,所以滤渣中主要为SiO2;
(2).根据沉淀溶解平衡得,较高C2O42-浓度,有利于沉淀的形成,使Ca2+沉淀完全;
(3). 草酸钙固体存在沉淀溶解平衡,增加草酸跟离子的浓度能够抑制草酸钙固体的溶解;
(4). ①反应物为:MnO4-,H+,H2C2O4,Mn元素被还原,被氧化的为C元素,则反应离子方程式为:2MnO4-+6H++5H2C2O4==2Mn2++10CO2↑+8H2O;②滴定终点,草酸完全被氧化,则滴入的高锰酸钾不能被反应,溶液从无色变为紫红色,且30s内不褪色;③消耗高锰酸钾的量为0.019*0.02mL*10=0.0038mol,则参与反应的草酸钙的物质的量为0.0095mol,则蛋壳中含有碳酸钙的质量为0.0095*100=0.95g,所以蛋壳中CaCO3的质量分数=95%;因为过程中加入两次草酸铵,所以生成的草酸比实际钙元素结合的草酸跟的量大,即求得的钙含量大于实际值。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
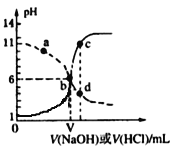
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+) > c(Cl-) > c(OH-) > c(BOH)
C. c、d两点溶液混合后微粒之间存在关系:c(H+) = c(OH-) + c(BOH)
D. b点时两种溶液中水的电离程度相同,且V=20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是

A. 稀释后A酸溶液的酸性比B酸溶液弱
B. a=5时,A是强酸,B是弱酸
C. 若A、B都是弱酸,则5>a>2
D. A、B两种酸济液物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。下列说法错误的是( )
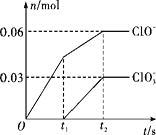
A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.42NA
C. 原苛性钾溶液中KOH的物质的量为0.3 mol
D. 生成物中Cl-的物质的量为0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
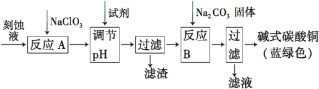
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,![]() 减小
减小
D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42—、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3—、NO3—
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32—
D. 常温下AG=lg[c(H+)/c(OH-)]=12的溶液中:Na+、K+、S2O32—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com