
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,![]() 减小
减小
D. 加入NaOH固体,溶液pH减小
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
请完成下列填空:
(1)写出一个包含上述体系中七种物质的氧化还原反应方程式(无需配平):_________________________;上述反应中,还原产物是_____________,每转移1 mol电子,生成Cl2 _____ L(标准状况)。
(2)上述反应体系中,有些短周期元素的简单离子核外电子排布相同,它们的简单离子半径由大到小的顺序为______________(用离子符号表达)。
(3)氯原子的最外层电子排布式为_____________________,氯原子核外共有____种不同运动状态的电子。
(4)在上述反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。比较该反应中的氧化剂和氧化产物的氧化性强弱_______>________。
(5)请用原子结构理论解释上述含7种物质的氧化还原反应体系中,属于同一主族两种元素非金属性的强弱,____>______;______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
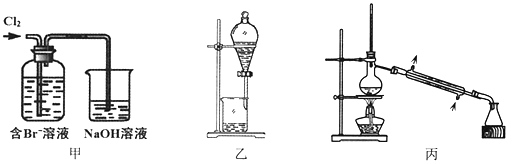
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在5种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
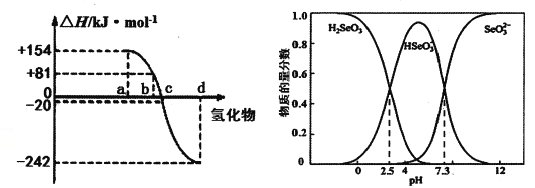
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
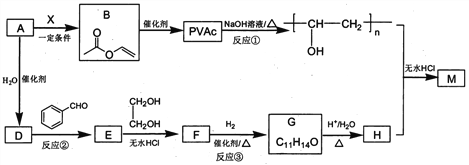
己知:R、Rˊ、Rˊˊ为H原子或烃基
I. R'CHO+ R"CH2CHO![]()
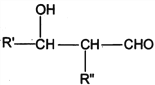
![]()
![]()
II. RCHO+![]()
![]()
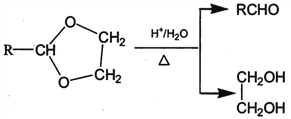
(1)标准状况下,4.48L气态烃A的质量是5.2g,则A的结构简式为___________________。
(2)己知A→B为加成反应,则X的结构简式为_______;B中官能团的名称是_________。
(3)反应①的化学方程式为______________________。
(4)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是_______________________。
(5)反应③的化学方程式为____________________________。
(6)在E→F→G→H的转化过程中,乙二醇的作用是__________________________。
(7)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定铝热反应实验所得“铁块”的成分,某学生兴趣小组设计实验流程如图所示。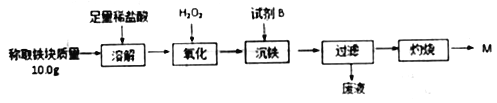
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)取溶解操作得到的溶液,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的氧化铁外,还有一个原因是_______________。
(2)沉铁操作应调节溶液pH的范围的为________,试剂B 选择______。(填序号)
a.稀盐酸 b.氧化铁 c.MgCO3固体 d.氨水
(3)已知常温下Fe(OH)3的Ksp=1.1×10-36,则铁完全沉淀时溶液中c(Fe3+)=_____mol/L。
(4)根据流程得到的固体M质量_____(填“能”或“不能”)计算出铁块中金属铁的质量,原因是________________。
(5)另有小组采用滴定的方式测定“铁块”中铁的含量(铁元素只存在Fe和Fe2O3),测定方式如下:
I.取10g“铁块”粉碎,加入足量氢氧化钠溶液充分反应,过滤、洗涤、干燥,得到8.88g固体。将固体加入足量盐酸溶解,获得200mL溶液A;
II.取出10mL 溶液A 于锥形瓶,先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+;
III.加入一定量的硫酸和磷酸,并滴加指示剂。再向锥形瓶中滴加0.1000mol/LK2Cr2O7溶液,恰好完全反应时,共消耗12.50mL K2Cr2O7溶液。发生反应:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
①步骤I中加入足量氢氧化钠溶液的作用为________________________。
②请计算样品中Fe单质的质量分数__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面图示回答问题:
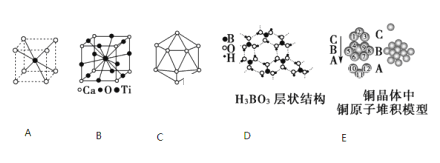
(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com