
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
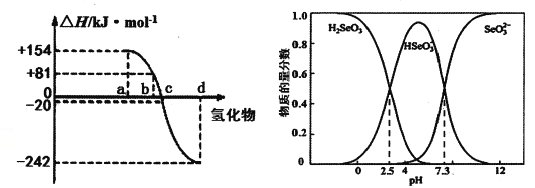
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
【答案】 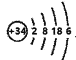 氧族元素原子的最外层电子数均为6 Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol H2SeO3+OH一=HSeO3一+H2O H2O+ H2SeO3+2SO2=Se+ 2H2SO4 ac 10-7.3
氧族元素原子的最外层电子数均为6 Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol H2SeO3+OH一=HSeO3一+H2O H2O+ H2SeO3+2SO2=Se+ 2H2SO4 ac 10-7.3
【解析】(1)硫原子核外电子排布为![]() ,硒(34Se)在周期表中位于下方,电子层应该为四层,最外层有6个电子,原子结构示意图
,硒(34Se)在周期表中位于下方,电子层应该为四层,最外层有6个电子,原子结构示意图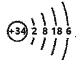 ;正确答案:
;正确答案: 。
。
(2)氧族元素原子的最外层电子数均为6,均能与2个氢原子形成2个共价键,所以氧族元素单质均能与H2反应生成H2X;正确答案:氧族元素原子的最外层电子数均为6 。
(3)O2、S分别与H2化合,均为放热反应,Se、Te分别与H2化合均为吸热反应,且Se的非金属性强于Te,所以吸收的热量要小一些,依据图形可以看出+81 kJ/mol为Se(s)与H2(g)化合的热效应;方程式为Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol;正确答案: Se(s)+H2(g)=H2Se(g) △H=+81 kJ/mol。
(4)①从图像可出,向亚硒酸溶液滴入NaOH溶液至pH =5时,溶液中HSeO3一离子浓度最大,所以过程中主要反应的离子方程式H2SeO3+OH一=HSeO3一+H2O;正确答案:H2SeO3+OH一=HSeO3一+H2O。
②在pH<0的酸性环境下,向H2SeO3溶液中通入还原性气体SO2,就能够把+4价的Se还原到0价,+4价的硫氧化到+6价,反应的化学方程式是H2O+ H2SeO3+2SO2=Se+ 2H2SO4;正确答案:H2O+ H2SeO3+2SO2=Se+ 2H2SO4。
③从图像看出,H2SeO3第一步电离平衡常数为 c(HSeO3一)×c(H+)/c(H2SeO3),当c(H+)=10-2.5mol/L,c(HSeO3一)= c(H2SeO3),K1=10-2.5; NaHSeO3溶液水解平衡常数为Kh=Kw/ K1=10-14/10-2.5=10-11.5,水解能力小于电离能力,该溶液显酸性,a正确;溶液遵循电荷守恒规律:c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)+c(Na+),b错误;在Na2SeO3溶液中,水解显碱性,所以c(SeO32-》c(HSeO3-)> c(H2SeO3)顺序正确;c正确;正确选项ac。
④根据图像可知,常温下,H2SeO3第二步电离平衡常数为c(SeO32-) ×c(H+)/ c(HSeO3一);当c(H+)=10-7.3mol/L,c(HSeO3一)= c(SeO32-),K2=10-7.3;正确答案:10-7.3。


科目:高中化学 来源: 题型:
【题目】2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.制纳米碳酸钙:在浓CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
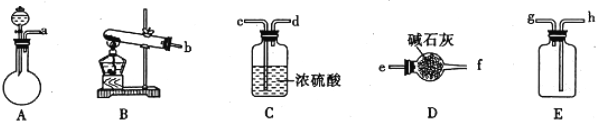
(1)实验室中若用浓氨水和生石灰制取并收集干燥的NH3,请选择装置并按气流方向连接各仪器接口___________(填装置接口顺序);若要制取并收集干燥的CO2,则需选用上述仪器装置中的_____________(填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是______,试写出制纳米级碳酸钙的离子方程式____________________________________。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备纳米TiO2:可将TiCl4水解产物经加热脱水制得纳米级TiO2。已知25℃时,Ksp[Ti(OH)4]=7.94×10-54,该温度下测得TiCl4溶液的pH=3,则此时溶液中c(Ti4+)=______________。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的______________(填字母代号)。

(5)滴定終点的现象是______________________________________________________。
(6)滴定分析时,称取TiO2试样1.80g,消耗0.400mol·L-1 NH4Fe(SO4)2标准溶液45.00mL,则试样中TiO2的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:
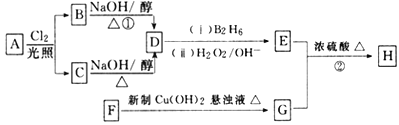
已知:R-CH=CH2![]() RCH2CH2OH (B2H6为乙硼烷)。
RCH2CH2OH (B2H6为乙硼烷)。
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O。A的分子式是___________;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为___________________;
(3)在催化剂存在下1molF与2molH2反应,生成3-苯基-1-丙醇。F的结构简式是__________________;
(4)反应①的反应类型是____________________;
(5)反应②的化学方程式为______________________________________________;
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式_________________________________。(写任何一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molNH3和5molO2充入定容密闭容器中,在催化剂存在下进行下列反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=- 1025 kJ/mol,当达到平衡状态时,下列说法中正确的是
4NO(g)+6H2O(g) △H=- 1025 kJ/mol,当达到平衡状态时,下列说法中正确的是
A. 生成4molNO B. NH3和NO物质的量之和为4mol
C. 放出1025kJ的热量 D. 平衡时容器内气体压强和开始时压强相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,![]() 减小
减小
D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
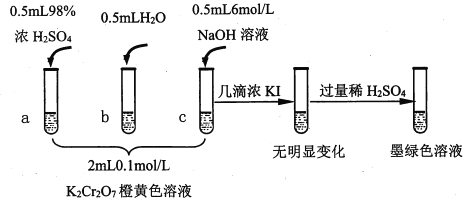
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
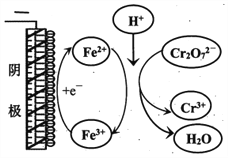
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就在你身边
(1)汽车尾气是城市空气污染来源之一,汽车尾气中含有CO和NO等有害物质。通过特殊的催化装置,可以使CO与NO相互反应生成无害且稳定的气体N2和CO2,反应的化学方程式是_____________。若反应生成1molN2,转移的电子数目为_______________。(NA表示阿伏加德罗常数的值)
(2)Cl2+2NaOH=NaCl+NaClO+H2O是工业上制84消毒液的原理,把上述化学方程式改为离子方程式,并用双线桥法标明电子转移的方向和数目。_________________
(3)在一定的温度和压强下,1体积X2 (气)跟3体积Y2 (气)化合生成2体积化合物,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如下页图所示: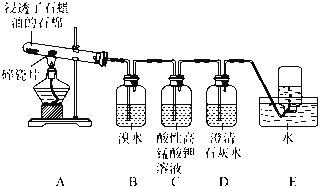
(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34![]() C8H18+甲 甲
C8H18+甲 甲![]() 4乙
4乙
甲的分子式为________;乙的结构简式为________。
(2)B装置中实验现象可能是________,写出化学方程式:________________________;反应类型是________。
(3)C装置的现象是____________,反应类型是____________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置________(填序号)实验现象判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,简述理由:__________________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是__________________(填序号,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com