
【题目】某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如下页图所示: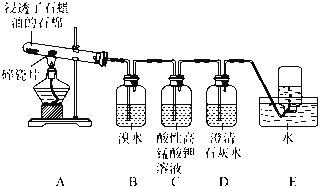
(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34![]() C8H18+甲 甲
C8H18+甲 甲![]() 4乙
4乙
甲的分子式为________;乙的结构简式为________。
(2)B装置中实验现象可能是________,写出化学方程式:________________________;反应类型是________。
(3)C装置的现象是____________,反应类型是____________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置________(填序号)实验现象判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,简述理由:__________________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是__________________(填序号,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
【答案】 C8H16 CH2===CH2 橙色(或橙黄色) 褪去 CH2===CH2+Br2―→CH2Br—CH2Br 加成反应 紫色(或紫红色)褪去 氧化反应 D 若乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大 BC B
【解析】(1)石油裂化属于化学反应,遵循原子个数守恒,![]() 甲,所以甲分子式为:
甲,所以甲分子式为:![]() ;根据方程式:
;根据方程式:![]() 乙,结合原子个数守恒可以知道,乙为:
乙,结合原子个数守恒可以知道,乙为:![]() ,结构简式为:
,结构简式为:![]() ;正确答案: C8H16; CH2=CH2 。
;正确答案: C8H16; CH2=CH2 。
(2) 乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色,方程式为: CH2===CH2+Br2―→CH2Br—CH2Br;正确答案:橙色(或橙黄色) 褪去; CH2===CH2+Br2―→CH2Br—CH2Br ; 加成反应。
(3) 乙烯具有还原性,能够被酸性高锰酸钾溶液氧化,导致高锰酸钾溶液褪色;反应:![]() →
→![]() ;正确答案:紫色褪色(或变浅);氧化反应。
;正确答案:紫色褪色(或变浅);氧化反应。
(4) 乙烯与酸性高锰酸钾溶液反应生成二氧化碳,进入到澄清的石灰水中,石灰水变浑浊,因此可以根据此现象判定结论的真实性;为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,具体操作为乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大;正确答案:D;若乙烯与溴发生取代反应则生成溴化氢,使溶液的酸性增强,pH变小;若乙烯与溴发生加成反应,则溴被消耗,溶液的酸性减弱,pH增大。
(5)烃都不溶于水,烷烃与溴水、酸性高锰酸钾溶液、氢氧化钠溶液等不发生反应,而乙烯与溴水、酸性高锰酸钾溶液等发生反应;因此检验甲烷和乙烯的方法可以用溴水或酸性高锰酸钾溶液,乙烯均能使上述溶液褪色,而甲烷不能;BC正确;酸性高锰酸钾溶液能够把乙烯氧化为二氧化碳,溴水与乙烯发生加成生成液态油状物,因此除去甲烷中乙烯的方法是气体通过装溴水的洗气瓶,可以达到目的,B正确;正确选项:BC ;B。


科目:高中化学 来源: 题型:
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
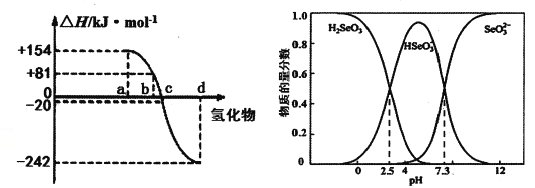
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业流程如图所示,下列说法不正确的是
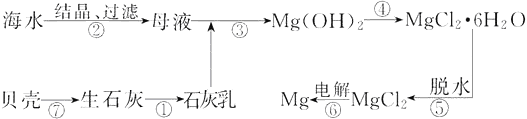
A. 用此法提取镁的优点之一是原料来源丰富
B. 在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯
C. 步骤⑥电解MgCl2时,副产物Cl2可以循环利用
D. 上述工艺流程中的反应未涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常见无机物A、B、C、D、E、X存在如图转化关系。已知A、B、C、D的焰色反应都呈黄色,其中A为单质,X是常见的无色无味气体(部分生成物和反应条件略去)。
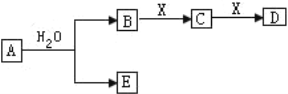
请回答:
(1)组成单质A的元素符号为_____。
(2)写出由C转化为D的化学方程式________________________________________。
II.A、B、C、D为三种常见物质。A是金属单质,且A的合金用量最大。这四种物质具有如图所示的转化关系(部分生成物和反应条件略去)。
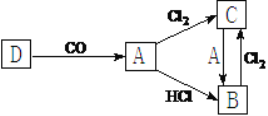
请回答:
(1)向溶液C中滴加硫氰化钾溶液,溶液变____________色。
(2)写出图中C+A![]() B的离子方程式____________________________________。
B的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面图示回答问题:
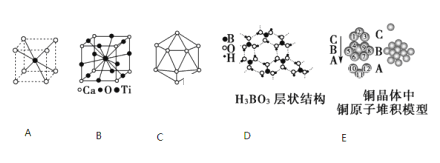
(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础]
防晒剂(M)CH3O![]() CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
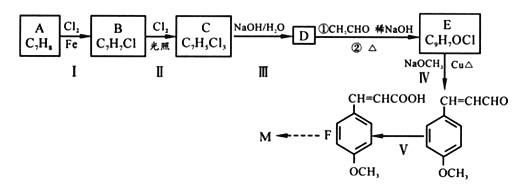
已知:(1)通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
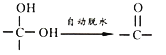
(2)![]()
(1)M中醚键是一种极其稳定的化学键,除此之外还含有官能团的名称为_______________。
(2)A的核磁共振氢谱中显示有_____种吸收峰;物质B的名称______________。
(3)C 的结构简式______;D→E转化过程中第①步的化学反应方程式____________________。
(4)完成V的反应条件是_________;IV 的反应类型为______________________。
(5)A也是合成阿司匹林(![]() )的原料,
)的原料,![]() 有多种同分异构体。写出符合下列条件的同分异构体的结构简式____________(任写出一种 )。
有多种同分异构体。写出符合下列条件的同分异构体的结构简式____________(任写出一种 )。
a.苯环上有3 个取代基 b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg c.苯环上的一氯代物有两种
(6)以F及乙醛为原料,合成防哂剂CH3O![]() CH=CHCOOCH2CH2CH2CH3的路线为_______(用流程图表示)。流程示例:CH2=CH2
CH=CHCOOCH2CH2CH2CH3的路线为_______(用流程图表示)。流程示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A. NH3(g)+5/4O2(g)===NO(g)+3/2H2O(g) ΔH=-a_kJ·mol-1
B. C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-b_kJ·mol-1
C. 2CO(g)+O2(g)===2CO2(g) ΔH=-c_kJ·mol-1
D. CH3CH2OH(l)+1/2O2(g)===CH3CHO(l)+H2O(l) ΔH=-d_kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行H2(g)+Br2(g)![]() 2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
A. 升温 B. 降温 C. 增压 D. 减压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转化的说法不正确的是( )
A.手机电池充电:电能转化为化学能B.铝热剂焊接钢轨:化学能转化为热能
C.植物光合作用:太阳能转化为化学能D.太阳能电池:化学能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com