
【题目】在密闭容器中进行H2(g)+Br2(g)![]() 2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
A. 升温 B. 降温 C. 增压 D. 减压
【答案】AC
【解析】
要想使容器内气体的颜色加深,就需要加大Br2 的浓度,加大Br2 浓度的方法结合选项有两种:1、利用平衡移动原理升高温度反应向吸热的方向移动,Br2 浓度增大,颜色加深;2、减小容器的体积即加大容器的压强,本反应由于反应前后系数相等,压强变化不会带来平衡的移动,但体积减小,Br2 浓度增大,颜色加深。
A.升温时,平衡逆向移动,Br2 的浓度增大,颜色加深,故A项正确;B.降温时,平衡正向移动,Br2 的浓度减小,颜色变浅,故B项错误;C.增大压强时,容器体积减小,平衡不移动,但Br2浓度增大,颜色加深,故C项正确;D.减小压强时,容器体积增大,平衡不移动,但Br2浓度减小,颜色变浅,故D项错误。综上,本题选AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如下页图所示: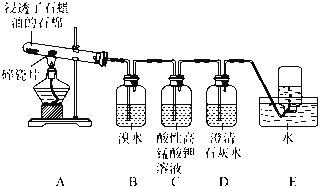
(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷烃发生如下反应,反应式已配平:C16H34![]() C8H18+甲 甲
C8H18+甲 甲![]() 4乙
4乙
甲的分子式为________;乙的结构简式为________。
(2)B装置中实验现象可能是________,写出化学方程式:________________________;反应类型是________。
(3)C装置的现象是____________,反应类型是____________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳。根据本实验中装置________(填序号)实验现象判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的pH,简述理由:__________________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是__________________(填序号,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中
B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)碳元素原子核外有_____个未成对电子,最外层有_____种能量不同的电子。CH4 分子的空间构型为_____,是_____分子。(填“极性”或“非极性”)
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_____(填编号)
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸是强酸,硅酸是弱酸 d.碳原子半径比硅原子小
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K_____。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施_____、_____。
(3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 晶体的晶胞结构与NaCl晶体的相似
晶体的晶胞结构与NaCl晶体的相似![]() 如图所示
如图所示![]() ,但因为
,但因为![]() 晶体中含有的哑铃形
晶体中含有的哑铃形![]() 的存在,使晶胞沿一个方向拉长。下列关于
的存在,使晶胞沿一个方向拉长。下列关于![]() 晶体的说法中正确的是
晶体的说法中正确的是![]()

A. 1个![]() 周围距离最近且等距离的
周围距离最近且等距离的![]() 数目为4
数目为4
B. 该晶体中的阴离子和O2是等电子体
C. ![]() 克
克![]() 晶体中含阴离子0.2mol
晶体中含阴离子0.2mol
D. 与每个![]() 距离相等且最近的
距离相等且最近的![]() 共有12个
共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素关于金属性或非金属性的强弱比较错误的一组是( )
A.金属性:K>NaB.金属性:B>Al
C.非金属性:Cl>PD.非金属性,F>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com