
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
科目:高中化学 来源: 题型:
【题目】为测定铝热反应实验所得“铁块”的成分,某学生兴趣小组设计实验流程如图所示。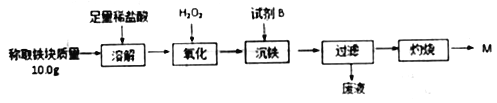
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)取溶解操作得到的溶液,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的氧化铁外,还有一个原因是_______________。
(2)沉铁操作应调节溶液pH的范围的为________,试剂B 选择______。(填序号)
a.稀盐酸 b.氧化铁 c.MgCO3固体 d.氨水
(3)已知常温下Fe(OH)3的Ksp=1.1×10-36,则铁完全沉淀时溶液中c(Fe3+)=_____mol/L。
(4)根据流程得到的固体M质量_____(填“能”或“不能”)计算出铁块中金属铁的质量,原因是________________。
(5)另有小组采用滴定的方式测定“铁块”中铁的含量(铁元素只存在Fe和Fe2O3),测定方式如下:
I.取10g“铁块”粉碎,加入足量氢氧化钠溶液充分反应,过滤、洗涤、干燥,得到8.88g固体。将固体加入足量盐酸溶解,获得200mL溶液A;
II.取出10mL 溶液A 于锥形瓶,先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+;
III.加入一定量的硫酸和磷酸,并滴加指示剂。再向锥形瓶中滴加0.1000mol/LK2Cr2O7溶液,恰好完全反应时,共消耗12.50mL K2Cr2O7溶液。发生反应:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
①步骤I中加入足量氢氧化钠溶液的作用为________________________。
②请计算样品中Fe单质的质量分数__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面图示回答问题:
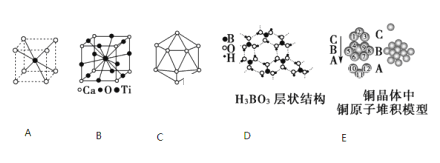
(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A. NH3(g)+5/4O2(g)===NO(g)+3/2H2O(g) ΔH=-a_kJ·mol-1
B. C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-b_kJ·mol-1
C. 2CO(g)+O2(g)===2CO2(g) ΔH=-c_kJ·mol-1
D. CH3CH2OH(l)+1/2O2(g)===CH3CHO(l)+H2O(l) ΔH=-d_kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物 A 为芳香族化合物,相互转化关系如下图所示回答下列问题:
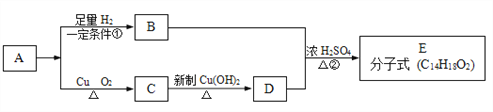
(1)写出反应类型:①_____;②_____。
(2)写出 B、D 合成E 的化学方程式:____________。
(3)写出与 D 互为同分异构体且属于芳香族化合物所有有机物的结构简式:_______________
(4)写出实验室由 制备
制备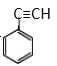 的合成路线。
的合成路线。![]() ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行H2(g)+Br2(g)![]() 2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
2HBr(g)△H<0反应达到平衡后,欲使颜色加深,应采取的措施是
A. 升温 B. 降温 C. 增压 D. 减压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释中,不正确的是![]()
A. 水在结冰时体积膨胀,是由于水分子中存在分子间氢键
B. 水很稳定![]() 以上才会部分分解
以上才会部分分解![]() 是因为水中含有大量的氢键所致
是因为水中含有大量的氢键所致
C. MgO的熔点比![]() 高主要是因为MgO的晶格能比
高主要是因为MgO的晶格能比![]() 大
大
D. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,错误的是( )
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为零
D.化学反应中,纯液体物质不能计算其速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]() = 64
= 64
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ=kaⅡ且kbⅠ=kbⅡ,则x的值一定为1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com