
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]() = 64
= 64
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ=kaⅡ且kbⅠ=kbⅡ,则x的值一定为1
【答案】AD
【解析】H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
变化浓度(mol/L) n n 2n
平衡浓度(mol/L) 0.5-n 0.5-n 2n
w(HI)/%=![]() ,n=0.4,平衡常数 K=
,n=0.4,平衡常数 K=![]() 。A.反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则ka/kb=w2(HI)/w(H2)·w(I2)=K=64,A正确;B.容器I中前20 min内
。A.反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则ka/kb=w2(HI)/w(H2)·w(I2)=K=64,A正确;B.容器I中前20 min内
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
变化浓度(mol/L) m m 2m
平衡浓度(mol/L) 0.5-m 0.5-m 2m
w(HI)%=![]() ,m=0.25mol,容器I中前20 min的平均速率,v(HI)=0.25mol/L÷20min=0.0125molL-1min-1,B正确;C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=
,m=0.25mol,容器I中前20 min的平均速率,v(HI)=0.25mol/L÷20min=0.0125molL-1min-1,B正确;C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=![]() <K=64,反应正向进行,C错误;D.若两容器中,kaⅠ=kaⅡ且kbⅠ=kbⅡ,达到平衡状态相同,w(HI)/%为80%,则
<K=64,反应正向进行,C错误;D.若两容器中,kaⅠ=kaⅡ且kbⅠ=kbⅡ,达到平衡状态相同,w(HI)/%为80%,则
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.5 0.5 0
0 0 1
则x的值一定为1,D正确;答案选AD。


科目:高中化学 来源: 题型:
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用惰性电极电解CuSO4溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
B. 在Na2SiO3溶液中加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C. 在稀硝酸中加入过量的铁屑: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2 mol O3和3 mol O2的质量之比_____,分子数之比____,同温同压的密度之比为____,含氧原子数之比为________,体积之比为________。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为________________和_________________ 定律。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现用该浓硫酸配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______________(写仪器名称);
(2)经计算,欲配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为____mL,量取浓硫酸时应选用____规格的量筒;
A.10 mL B.50 mL C.100 mL D.200 mL
(3)在烧杯中稀释浓硫酸的实验操作为_____________________________。
(4)在配制过程中,若用量筒量取浓硫酸时,俯视刻度线,会使所配溶液浓度_________;若转移溶液时,不慎有少量溶液洒出,会使所配溶液浓度_________,若定容时,俯视容量瓶刻度线,会使所配溶液浓度_________(填“偏大、偏小、无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和如此丰富的化学变化,分类法的作用几乎是无可替代的。如:纯净物根据其组成和性质可进行如下分类。
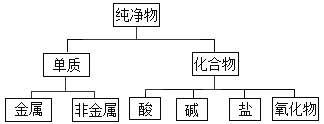
(1)如图所示的分类方法属于_______________。
(2)某化学兴趣小组对下列四组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
C.FeCl3溶液、蒸馏水、CaCO3悬浊液、Fe(OH)3胶体
D.NaOH、KOH、Ba(OH)2、Fe2O3
①填写下列空白:
A组 | B组 | C组 | D组 | |
分类标准 | 含氧酸 | ________ | 分散系 | ________ |
不属于该类别的物质 | ________ | Na2CO3 | ________ | Fe2O3 |
②写出①表中发生反应的化学方程式:
A+ B→气体__________________________;A+D__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键( )
A.一定是共价键B.一定是离子键
C.可能是共价键,也可能是离子键D.上述说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com