
【题目】(1)2 mol O3和3 mol O2的质量之比_____,分子数之比____,同温同压的密度之比为____,含氧原子数之比为________,体积之比为________。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为________________和_________________ 定律。
【答案】1:1 2:3 3:2 1:1 2:3 O3F2 阿伏加德罗定律 质量守恒定律
【解析】
(1)氧气和臭氧都是氧原子构成的不同单质,根据m=nM计算O3和O2的质量之比;根据阿伏加德罗定律可知,二者的分子数之比等于物质的量之比;在相同条件下,气体的密度之比是摩尔质量之比;根据N=nNA计算含有的氧原子数之比;根据阿伏加德罗定律可知,二者的体积之比等于物质的量是之比.
(2)根据质量守恒定律和阿伏加德罗定律,写出分解方程式为2OxFy![]() 3O2+2F2,则可推断化学式。
3O2+2F2,则可推断化学式。
(1)氧气和臭氧都是氧原子构成的不同单质,所以2 molO3和3 mol O2的质量之比1:1;根据阿伏加德罗定律可知,二者的分子数之比是2:3;在相同条件下,气体的密度之比是摩尔质量之比,因此二者的密度之比是48:32=3:2;由化学式可知,含有的氧原子数之比是1:1;根据阿伏加德罗定律可知,二者的体积之比是2:3。
故答案为:1:1;2:3;3:2;1:1;2:3.
(2)根据质量守恒定律和阿伏加德罗定律,写出分解方程式为2OxFy![]() 3O2+2F2,则A化学式为O3F2,故答案为:O3F2;阿伏加德罗定律和质量守恒定律.
3O2+2F2,则A化学式为O3F2,故答案为:O3F2;阿伏加德罗定律和质量守恒定律.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知有机物 A 为芳香族化合物,相互转化关系如下图所示回答下列问题:
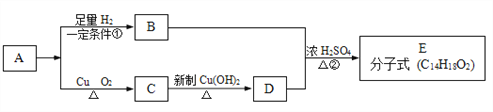
(1)写出反应类型:①_____;②_____。
(2)写出 B、D 合成E 的化学方程式:____________。
(3)写出与 D 互为同分异构体且属于芳香族化合物所有有机物的结构简式:_______________
(4)写出实验室由 制备
制备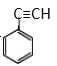 的合成路线。
的合成路线。![]() ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为________________________________________。
(2)仪器b的名称是__________________,其作用是____________________________。
(3)若撤去装置B,对实验的影响是______________________________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充反应: CCl3CHO +OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点,发生反应: I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
滴定时所用指示剂是_____________________,达到滴定终点的现象是_____________,测得产品的纯度为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~③仪器的名称:
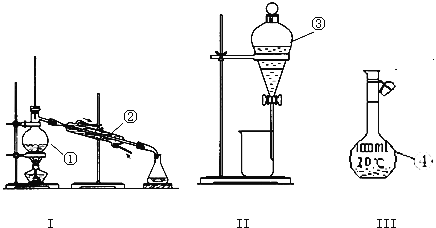
①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法正确的是 ( )
A. C2H5OH(乙醇)是化合物,所以它是电解质
B. 固体Na2SO4不能导电,所以它是非电解质
C. 易溶性强电解质的溶液中不存在溶质分子
D. BaSO4难溶于水,所以BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]() = 64
= 64
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ=kaⅡ且kbⅠ=kbⅡ,则x的值一定为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
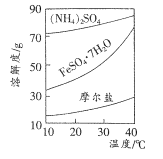
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和钠的化学性质相似,下列说法中能最好的解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.原子的最外层电子数相同
D.最高化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com