
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为________________________________________。
(2)仪器b的名称是__________________,其作用是____________________________。
(3)若撤去装置B,对实验的影响是______________________________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充反应: CCl3CHO +OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点,发生反应: I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
滴定时所用指示剂是_____________________,达到滴定终点的现象是_____________,测得产品的纯度为________________________________。
【答案】 MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O 球形冷凝管 冷凝回流三氯乙醛和乙醇 会使三氯乙醛的纯度更低 停止对A加热或控制滴加盐酸的量 淀粉溶液 蓝色变为无色,且半分钟内不变色 66.375%(答成66.38%、66.4%也得分)
Mn2++Cl2↑+2H2O 球形冷凝管 冷凝回流三氯乙醛和乙醇 会使三氯乙醛的纯度更低 停止对A加热或控制滴加盐酸的量 淀粉溶液 蓝色变为无色,且半分钟内不变色 66.375%(答成66.38%、66.4%也得分)
【解析】 (1)装置A中二氧化锰与浓盐酸加热反应制备氯气,反应的离子方程式为:MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O;正确答案:MnO2+4H++2Cl–
Mn2++Cl2↑+2H2O;正确答案:MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)仪器b的名称是球形冷凝管,其作用是冷凝回流三氯乙醛和乙醇;正确答案:球形冷凝管;冷凝回流三氯乙醛和乙醇。
(3)饱和食盐水的作用是吸收氯气中氯化氢气体,若撤去装置B,会发生副反应:C2H5OH+HCl→C2H5Cl+H2O,使三氯乙醛的纯度更低,正确答案:会使三氯乙醛的纯度更低。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是停止对A加热或控制滴加盐酸的量;正确答案:是停止对A加热或控制滴加盐酸的量。
(5)根据I2+2S2O32-=2I-+S4O62-反应,可以计算出剩余的碘的量:n(I2)= 20×10-3×0.020/2=2×10-4mol,用于和HCOO-反应的碘的量为20×10-3×0.100-2×10-4=1.8×10-3 mol,根据反应关系:CCl3CHO--- HCOO--- I2可知,n(CCl3CHO)= 1.8×10-3 mol,质量为1.8×10-3×147.5=0.2655g,测得产品的纯度0.2655/0.40×100%=66.375%;正确答案:66.375%(答成66.38%、66.4%也得分)。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A. 在沸水中加入0.1mL5mol/L的FeCl3制得胶体,Fe(OH)3胶体粒子数目为5×10-4NA
B. 0.5mol/L MgCl2溶液中含有Cl-的数目为NA
C. 标准状况下,5.6 L H2O含有的电子数目为2.5NA
D. 13.2g CO2和N2O形成的混合物含有的原子数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (X)、
(X)、![]() (Y)、
(Y)、![]() (Z)的分子式均为C8H8,下列说法正确的是
(Z)的分子式均为C8H8,下列说法正确的是
A. X的同分异构体只有Y和Z
B. Y、Z的二氯代物均只有三种
C. X、Y、Z中只有X的所有原子可能处于同一平面
D. X、Y、Z均可使溴水、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4。Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________________________。
II.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制务高纯PbO,其主要流程如下:
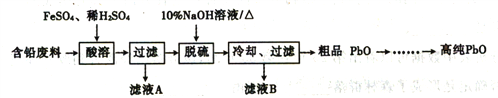
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成1molPbSO4时转移电子的物质的量为____mol。
(3)已知:PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)=NaHPbO2(aq),其溶解度曲线如图所示:
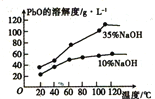
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量_________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)工业上利用硫化氢除去滤液A中少量的Pb2+,发生的反应为Pb2++H2S![]() PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
(5)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示:

①阴极的电极反应式为________________________;
②当有2.07gPb生成时,通过质子交换膜的n(H+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的离子方程式。
①钠和水反应____________________________________。
②硫酸铜溶液中滴加氢氧化钡溶液___________________________________。
(2)3.01×1023个OH-的物质的量为______mol,质量为_______g。
(3)将28g纯净的铁粉投入到200ml足量的稀盐酸中,该反应能够放出标准状况下的气体____L,实验后所得溶液中Fe2+的物质的量浓度为_________mol/L 。
(4)将200 mL 0.5 mol/LNaOH稀释成1000 mL后其物质的量浓度是_________mol/L 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用惰性电极电解CuSO4溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
B. 在Na2SiO3溶液中加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C. 在稀硝酸中加入过量的铁屑: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12 a/b
②m g该氯原子的物质的量为m/(aNA) mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子为17 mol
A. ①② B. ②④ C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2 mol O3和3 mol O2的质量之比_____,分子数之比____,同温同压的密度之比为____,含氧原子数之比为________,体积之比为________。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为________________和_________________ 定律。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com