
【题目】化学键是一种作用力,下列不属于化学键的是( )
A.离子键
B.氢键
C.极性共价键
D.非极性共价键
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+5HCl,发生的副反应为:C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)装置A中发生反应的离子方程式为________________________________________。
(2)仪器b的名称是__________________,其作用是____________________________。
(3)若撤去装置B,对实验的影响是______________________________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(5)测定产品的纯度:
①称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量碱液,充反应: CCl3CHO +OH-→CHCl3+HCOO-,HCOO-+I2=H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点,发生反应: I2+2S2O32-=2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
滴定时所用指示剂是_____________________,达到滴定终点的现象是_____________,测得产品的纯度为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
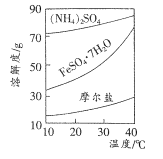
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和钠的化学性质相似,下列说法中能最好的解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.原子的最外层电子数相同
D.最高化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3(红褐色固体)。
(1)Fe(OH)3中铁元素化合价为______,该脱氧反应中还原剂是_________。
(2)某化学兴趣小组用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g氯化钠)进行如下两个实验。
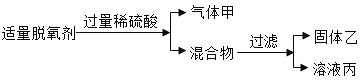
请回答:
①溶液丙中一定含有的金属阳离子是_________(写离子符号);
②检验溶液丙中Cl的方法是_____________________________________________。
将乙烘干后进行如下实验,物质之间的转化关系如图(部分产物略去)
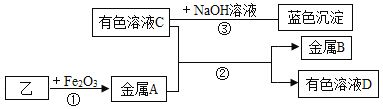
③写出反应②的离子方程式,并用双线桥法表示电子转移的方向和数目_________;
④向溶液C中加入BaCl2溶液,有白色沉淀产生,其离子方程式为____________;反应③的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料可制备C(丹皮酚)和D(树脂),其合成路线如下:

(1)A在空气中会缓慢变成粉红色,其原因是_____________________________________。
(2)A→B的反应类型为______________________;A生成D的反应中,试剂X(烃的含氧衍生物)为____________________(写结构简式)。
(3)只含有两个取代基的芳香化合物E是C的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E共有________种(不考虑立体结构),其中核磁共振氢谱为六组峰且峰面积比为1:1:2:2:2:2 的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是
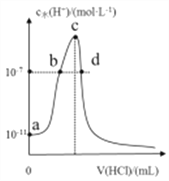
A. 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)-)
D. c点溶质为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( )
A.节约用水用电B.利用风力发电
C.增加植被面积D.燃烧煤炭供热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com