
【题目】设计如下实验探究橄榄石(仅含三种短周期元素)的组成和性质。
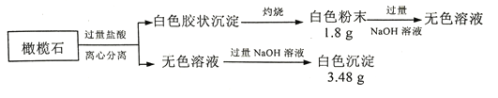
(1)橄榄石的组成元素是O和____、____(填元素符号),化学式为__________。
(2)写出白色粉末A的一种用途:__________________________。
(3)白色粉末A溶于NaOH溶液的离子方程式是 _________________________________。
【答案】Mg Si 2MgO·SiO2 光导纤维等合理即可 SiO2+2OH-=SiO32-+H2O
【解析】
橄榄石与盐酸反应后生成了白色胶状沉淀,推知该胶状沉淀为硅酸,灼烧后生成二氧化硅,质量为1.8g,则物质的量为![]() ,二氧化硅能溶于NaOH溶液生成Na2SiO3,橄榄石与过量盐酸反应后的无色溶液,与过量的NaOH溶液反应后,生成白色沉淀,该沉淀应是Mg(OH)2,质量为3.48g,则物质的量为
,二氧化硅能溶于NaOH溶液生成Na2SiO3,橄榄石与过量盐酸反应后的无色溶液,与过量的NaOH溶液反应后,生成白色沉淀,该沉淀应是Mg(OH)2,质量为3.48g,则物质的量为![]() ,因此该化合物中,硅元素与镁元素的物质的量之比为1:2,因此橄榄石的化学式为:2MgO·SiO2;
,因此该化合物中,硅元素与镁元素的物质的量之比为1:2,因此橄榄石的化学式为:2MgO·SiO2;
(1)根据以上分析可知,橄榄石的组成元素是O和Mg、Si,化学式为2MgO·SiO2,本题答案为:Mg;Si;2MgO·SiO2;
(2)白色粉末为二氧化硅,用途有:制造玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件、光学仪器、工艺品和耐火材料的原料,本题答案为:光导纤维等;
(3)白色粉未为二氧化硅,与NaOH溶液反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,
本题答案为:SiO2+2OH-=SiO32-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[Fe(CN)6]3可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是

A. 电解时阳极反应式为[Fe(CN)6]4e![]() [Fe(CN)6]3
[Fe(CN)6]3
B. 电解时阴极反应式为2HCO3-+2e![]() H2↑+2CO32-
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是

A. 对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g) 在t0时刻充入了一定量的NH3,平衡逆向移动
B. 对于反应2A(g)+B(g)![]() C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C(g)+D(g) ΔH < 0,p2 > p1,T1 > T2
C. 该图象表示的化学方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH < 0,y可以表示Y的百分含量
2Z(g) ΔH < 0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
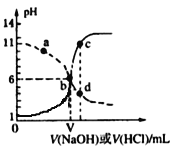
A. HA为弱酸,BOH为强碱
B. a点时,溶液中粒子浓度存在关系:c(B+) > c(Cl-) > c(OH-) > c(BOH)
C. c、d两点溶液混合后微粒之间存在关系:c(H+) = c(OH-) + c(BOH)
D. b点时两种溶液中水的电离程度相同,且V=20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
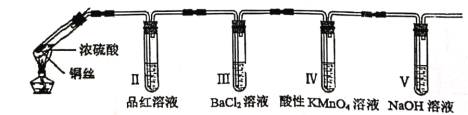
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯装置,请根据装置回答问题:
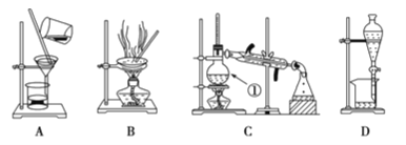
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_______,装置C中冷凝水从____通入。
(2)装量C中①的名称是________,装置D中的分液漏斗在使用之前应该进行的操作为__________,在分液时为使液体顺利滴下,应进行的操作为________________________。
(3)青蒿素是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯的一种无色针状晶体,是一种高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。
已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
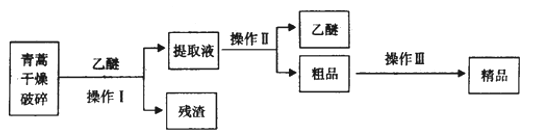
若要在实验室模拟上述工艺,操作Ⅰ选择的装置是_______,操作Ⅱ的名称是________,操作Ⅲ的主要过程可能是_______(填字母)
A. 加95%的乙醇,浓缩、结晶、过滤
B. 加水溶解,蒸发浓缩、冷却结晶、过滤
C. 加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_____________(填序号)。
(2)H2的燃烧热为_____________,C的燃烧热为_____________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为______________,其热化学方程式为_______________________。
(5)在某温度时,测得0.01 molL-1的NaOH溶液的pH为11。该温度下,水的离子积常数Kw =________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是

A. 稀释后A酸溶液的酸性比B酸溶液弱
B. a=5时,A是强酸,B是弱酸
C. 若A、B都是弱酸,则5>a>2
D. A、B两种酸济液物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com