
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_____________(填序号)。
(2)H2的燃烧热为_____________,C的燃烧热为_____________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为______________,其热化学方程式为_______________________。
(5)在某温度时,测得0.01 molL-1的NaOH溶液的pH为11。该温度下,水的离子积常数Kw =________。
【答案】 ①②③④ 285.8KJ/mol 393.5 kJ/mol 1429KJ 283kJ/mol CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ/mol 1×10-13
O2(g)===CO2(g) ΔH=-283.0 kJ/mol 1×10-13
【解析】(1)反应①②③④的焓变都小于0,都为放热反应;正确答案:①②③④。
(2)根据燃烧热的定义可知:H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol反应中,氢气的燃烧热为285.8 kJ/mol;正确答案:285.8 kJ/mol。根据燃烧热的定义可知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol反应可知,碳的燃烧热为393.5 kJ/mol;正确答案:285.8KJ/mol ; 393.5 kJ/mol。
O2(g)===H2O(l) ΔH=-285.8 kJ/mol反应中,氢气的燃烧热为285.8 kJ/mol;正确答案:285.8 kJ/mol。根据燃烧热的定义可知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol反应可知,碳的燃烧热为393.5 kJ/mol;正确答案:285.8KJ/mol ; 393.5 kJ/mol。
(3)根据H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol反应,1 mol氢气完全燃烧放热285.8 kJ,10 g H2(即5mol)燃烧生成液态水,放出的热量为1429KJ;正确答案:1429KJ。
O2(g)===H2O(l) ΔH=-285.8 kJ/mol反应,1 mol氢气完全燃烧放热285.8 kJ,10 g H2(即5mol)燃烧生成液态水,放出的热量为1429KJ;正确答案:1429KJ。
(4)根据反应:③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol,④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol;根据根据盖斯定律得:④-③,整理后为:CO(g)+
O2(g)===CO(g) ΔH=-110.5 kJ/mol,④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol;根据根据盖斯定律得:④-③,整理后为:CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ/mol ,燃烧热为283.0 kJ ; 正确答案:283kJ/mol; CO(g)+
O2(g)===CO2(g) ΔH=-283.0 kJ/mol ,燃烧热为283.0 kJ ; 正确答案:283kJ/mol; CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ/mol 。
O2(g)===CO2(g) ΔH=-283.0 kJ/mol 。
5)在某温度时,测得0.01 molL-1的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,Kw=c(H+)×c(OH-)=1×10-13;该温度下,水的离子积常数Kw =1×10-13;正确答案:1×10-13。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表,下列说法不正确的是
M(g)+N(s),所得实验数据如下表,下列说法不正确的是
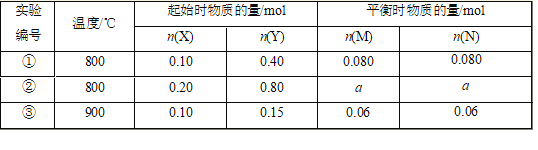
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究橄榄石(仅含三种短周期元素)的组成和性质。
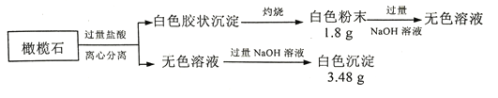
(1)橄榄石的组成元素是O和____、____(填元素符号),化学式为__________。
(2)写出白色粉末A的一种用途:__________________________。
(3)白色粉末A溶于NaOH溶液的离子方程式是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
![]()
![]() +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是__________.
(2)加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________________.
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是_______________.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号).
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取l0mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取l0mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验l后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。

回答下列问题:
(1)原溶液中不存在的离子有________,存在的离子有___________________。
(2)实验3中,图像中OA段反应的离子方程式为___________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
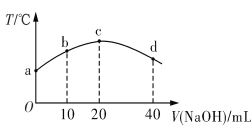
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com