
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
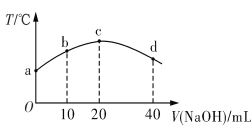
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
【答案】B
【解析】
试题A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;B、b点得到HNO2,和NaNO2混合溶液显酸性,说明电离大于水解,所以离子浓度大小为:c(NO2-)>c(Na+)>c(H+)>c(OH-),故B错误;C、a→c温度升高说明两者恰好完全中和,点两者恰好完全反应,而c→d温度降低,所水解为主,所以c点得到NaNO2溶液是强碱弱酸盐,水解溶液呈碱性,所以c(OH-)>c(HNO2),故C正确;D、d点混合溶液中当c(NaOH)较大时,得到NaOH和NaNO2混合溶液,所以离子的浓度为:c(Na+)>c(OH-)>c(NO2-)>c(H+),故D正确;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ/mol
O2(g)===H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_____________(填序号)。
(2)H2的燃烧热为_____________,C的燃烧热为_____________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为______________,其热化学方程式为_______________________。
(5)在某温度时,测得0.01 molL-1的NaOH溶液的pH为11。该温度下,水的离子积常数Kw =________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
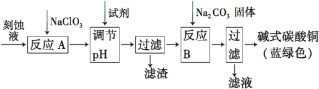
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
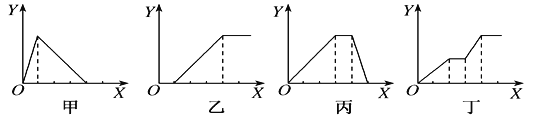
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,![]() 减小
减小
D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。
(2)写出②、③中可能发生反应的离子方程式。
②_______________________、________________、_______________________、________________。
③_____________________、________________。
(3)步骤②中不用氨水沉淀Fe3+的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示。有关它的说法中错误的是( )
![]()
A. 其二氯代物有4种 B. 它所有的原子均在同一平面上
C. 其分子式为C6H8 D. 它不可能是环丙烷的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的4/5,则原混合气体中N2的体积分数为
A. 33.3% B. 40% C. 60% D. 75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com