
【题目】下图是中学化学中常用于混合物的分离和提纯装置,请根据装置回答问题:
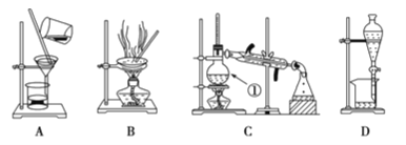
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_______,装置C中冷凝水从____通入。
(2)装量C中①的名称是________,装置D中的分液漏斗在使用之前应该进行的操作为__________,在分液时为使液体顺利滴下,应进行的操作为________________________。
(3)青蒿素是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯的一种无色针状晶体,是一种高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。
已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
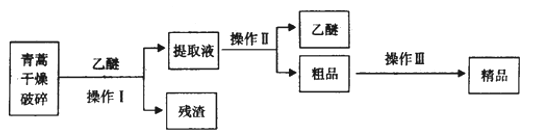
若要在实验室模拟上述工艺,操作Ⅰ选择的装置是_______,操作Ⅱ的名称是________,操作Ⅲ的主要过程可能是_______(填字母)
A. 加95%的乙醇,浓缩、结晶、过滤
B. 加水溶解,蒸发浓缩、冷却结晶、过滤
C. 加入乙醚进行萃取分液
【答案】引流 下口 蒸馏烧瓶 检漏 打开分液漏斗上方玻璃活塞 A 蒸馏 A
【解析】
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是引流,装置C冷凝水从下口入上口出,本题答案为:引流;下口;
(2)装置C中①的名称为蒸馏烧瓶,装置D中的分液漏斗在使用之前应该检查是否漏水,装置D在分液时为使液体顺利滴下,应进行的具体操作是打开分液漏斗上端的玻璃塞,并使凹槽对准小孔,本题答案为:蒸馏烧瓶;检漏;打开分液漏斗上方玻璃活塞;
(3)由流程图可知,操作I为过滤,选择的装置是A,操作II的名称是蒸馏,选择的装置是C,根据上面的分析可知,操作III的主要过程是粗品中加95%的乙醇,浓缩、结晶、过滤可得产品,故选A,本题答案为:A、蒸馏、A。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30% H2SO4。下图是处于工作状态的铅蓄电池示意图,若两电极的质量都增加且a极增加得更多。下列说法正确的是

A. a为铅蓄电池的正极
B. b电极发生的反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
C. 该铅蓄电池正在充电
D. 工作一段时间后,溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LH2O中含有共价数目为2NA
B. NA个氧气分子与NA个氢分子的质量比为8:1
C. 8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D. 4.6g金属钠与500mL 0.2mol/L的盐酸充分反应,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究橄榄石(仅含三种短周期元素)的组成和性质。
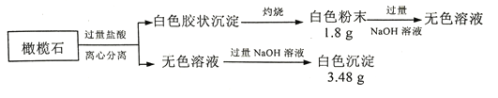
(1)橄榄石的组成元素是O和____、____(填元素符号),化学式为__________。
(2)写出白色粉末A的一种用途:__________________________。
(3)白色粉末A溶于NaOH溶液的离子方程式是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
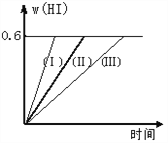
(1)达平衡时,I2(g)的物质的量浓度为___________ 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是___________,则乙条件可能是___________ 。(填入下列条件的序号)
①恒容条件下,升高温度; ②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
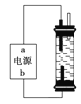
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com