
【题目】一定条件下存在反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容恒温密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容恒温密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数不同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
【答案】A
【解析】
A. 由于该反应正向是放热反应,且三个容器均恒容恒温密闭容器,因此容器Ⅰ、Ⅱ随着反应的进行温度一样,平衡时各物质的浓度也一样,正反应速率也相同,故A正确;
B.K只与温度有关,Ⅰ、Ⅲ两个容器恒容恒温,反应物的量不同反应的热效应不同,所以K相同,故B错误;
C. 如果容器容器Ⅰ、Ⅱ均在恒温恒容条件下反应,那么Ⅰ、Ⅱ是等效平衡,达到平衡A的物质的量相等,而现在在恒容绝热条件下反应,正向放热,Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中A的物质的量比容器Ⅱ中的多Ⅰ中A的物质的量和容器Ⅱ中的多,故C错误;
D. 如果温度相同时,容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和等于1,故D错误。
答案选A。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料。工业上用硫酸钠来制得硫化钠。制备硫化钠的反应原理为: Na2SO4(s)+4H2(g) ![]() Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为________,若只改变一个影响因素,当平衡移动时,K值________变化(填“一定”或“不一定”);当K值变大时,逆反应速率________.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说活错误的是________。
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe2O3固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.74g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.164g。则10分钟内H2的平均反应速率________。
(4)请写出向Ba(ClO)2溶液中通入足量SO2气体后所发生化学反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3达到化学平衡状态,下列说法一定正确的是( )
2NH3达到化学平衡状态,下列说法一定正确的是( )
A.每1 mol N≡N断裂的同时有2 mol N—H生成
B.N2、H2、NH3的浓度之比为1∶3∶2
C.N2减少的速率和NH3减少的速率之比为1∶2
D.气体体积为初始体积的0.7倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M(g)+N(g) ![]() P(g)+Q(g)反应的平衡常数和温度的关系如下:
P(g)+Q(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答:
(1)该反应的平衡常数表达式K=_____________ ,△H_____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的M和0.80mol的N,若反应6s内M的平均反应速率v(M)=0.003 mol·L-1·s-1。,则6s时c(M)=______ mol·L-1, P的物质的量为_______mol;若反应经一段时间后,达到平衡时N的转化率为______。
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(M)不随时问改变 d.单位时间里生成P和Q的物质的量相等
(4)1200℃时反应P(g)+Q(g) ![]() M(g)+N(g)的平衡常数的值为______________。
M(g)+N(g)的平衡常数的值为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH![]() CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
A.该星球表面温度很高B.该星球表面温度很低
C.该反应为放热反应D.高温下稳定性CH2=CHOH>CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小![]() 对环境的影响,在倡导“低碳”的同时,还需加强对
对环境的影响,在倡导“低碳”的同时,还需加强对![]() 创新利用的研究.
创新利用的研究.![]() 时,将
时,将![]() 和
和![]() 充入3L密闭容器中,发生反应
充入3L密闭容器中,发生反应![]() ,
,![]() ,容器中
,容器中![]() 的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为
的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为![]() ,改变某一条件重新进行上述反应,
,改变某一条件重新进行上述反应,![]() 的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
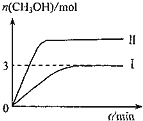
A.曲线Ⅱ对应的条件改变是增大压强
B.![]() 时,上述反应平衡常数为
时,上述反应平衡常数为![]() ,则
,则![]()
C.在![]() ,若起始时向容器中充入5mol
,若起始时向容器中充入5mol![]() 、5mol
、5mol![]() 、5mol
、5mol![]() 和5mol
和5mol![]() ,则达平衡前
,则达平衡前![]() 正
正![]() 逆
逆![]()
D.在![]() ,若起始时向容器由充入
,若起始时向容器由充入![]() 、6mol
、6mol![]() ,平衡时容器内压强
,平衡时容器内压强![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:

己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。

①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com