
【题目】短周期元素a、b、c、d的原子序数依次增大,c和d位于同主族且原子序数相差8;基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,c原子s能级电子总数与p能级电子数相等,基态e原子的M层上有2个未成对电子且无空轨道。
(1)在a、b、c中,第一电离能由大到小排序为 (用元素符号表示);基态e原子的价层电子排布式为 。
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是 。已知(dab)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,1mol(dab)2分子含σ键的数目为 。
(3)写出一种与dab-互为等电子体的分子 (填化学式)。ac32-的中心原子杂化类型为 ;dc32-的空间构型为 。
(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为 g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA),晶胞中c粒子的配位数为 。
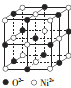
(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为 。
【答案】(1)N>O>C 3d84s2;
(2)分子晶体;5×6.02×1023;
(3)CO2(或N2O);sp2;三角锥型;
(4)![]() ;6;
;6;
(5)1:11;
【解析】
试题分析:短周期元素a、b、c、d的原子序数依次增大,基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,a为C元素;c原子s能级电子总数与p能级电子数相等,c为O元素;则b为N元素;c和d位于同主族且原子序数相差8;则d为S元素;基态e原子的M层上有2个未成对电子且无空轨道,电子排布为3d84s2,为Ni元素。
(1)N原子的2p为半充满状态,较为稳定,第一电离能由大到小排序为N>O>C,基态e原子的价层电子排布式为3d84s2,故答案为:N>O>C;3d84s2;
(2)配合物Ni(CO)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂,固态时构成分子晶体。已知(SCN)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,(SCN)2的结构为N≡C-S-S-C≡N,1mol(SCN)2分子含σ键的数目为5×6.02×1023,故答案为:分子晶体;5×6.02×1023;
(3)与SCN-互为等电子体的分子有CO2(或N2O),CO32-中C的价层电子对数=3+![]() (4+2-2×3)=3,杂化类型为sp2,SO32-中S的价层电子对数=3+
(4+2-2×3)=3,杂化类型为sp2,SO32-中S的价层电子对数=3+![]() (6+2-2×3)=4,杂化类型为sp3,空间构型为三角锥型,故答案为:CO2(或N2O);sp2;三角锥型;
(6+2-2×3)=4,杂化类型为sp3,空间构型为三角锥型,故答案为:CO2(或N2O);sp2;三角锥型;
(4)晶胞中O2-离子数目为1+12×![]() =4,故晶胞质量为4×
=4,故晶胞质量为4×![]() g,晶胞体积为(a×10-10cm)3,故晶胞密度为
g,晶胞体积为(a×10-10cm)3,故晶胞密度为 g/cm3=
g/cm3=![]() g/cm3,Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×
g/cm3,Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×![]() +6×
+6×![]() =4,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,故Ni2+的配位数y=6,故答案为:
=4,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,故Ni2+的配位数y=6,故答案为:![]() ;6;
;6;
(5)设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96-x)mol,晶体呈电中性,可知3x+2×(0.96-x)=2×1,解得x=0.08mol,故Ni2+为(0.96-x)mol=0.88mol,Ni3+、Ni2+的数目之比=0.08:0.88=1:11,故答案为:1:11。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
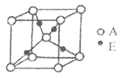
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/LNaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是
A.200mLB.250mLC.425mLD.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06g![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是( )
的物质的量的关系的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验事实的解释中正确的是
选项 | 问题 | 解释 |
A | 实验室不能配制含有Fe3+、MnO4-、SO42-、Ba2+的中性溶液 | Fe3+水解呈酸性 |
B | 含有H+、Fe2+的溶液中不能大量存在Ag+ | 含有Ag+的溶液必然含有NO3-,在酸性条件下,可氧化Fe2+ |
C | 将氨气通入水中,形成的水溶液能导电 | 氨气是电解质 |
D | 在FeBr2溶液中通入过量Cl2,溶液变为棕黄色 | 发生反应2Fe2++Cl2===2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.5gZn投入到vmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
A.所得气体在标准状况下的体积 B.所得气体的质量
C.所得溶液的浓度 D.原硫酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
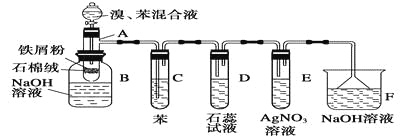
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_________________________________________。
(2)试管C中苯的作用是__________________。反应开始后,观察D和E两试管,看到的现象为________________________________________________________________________。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·银川模拟)工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是_____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2AlCl3+X↑,设计实验确定气体X的__________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:___________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:__________________________。
③要进一步获得金属铝,工业上采用的冶炼方法是_______________,
有关反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略)。下列设计不能达到目的的是( )
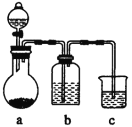
选项 | 气体 | 装置中药品 | ||
a | b | c | ||
A | C2H2 | 饱和食盐水+电石 | CuS04溶液 | 溴水 |
B | CO2 | 稀盐酸+石灰石 | 饱和NaHC03溶液 | 苯酚蚋溶液 |
C | C2H4 | 溴乙烷+ NaOH乙醇溶液 | 水 | K2z Cr207,酸性溶液 |
D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com