
【题目】将32.5gZn投入到vmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
A.所得气体在标准状况下的体积 B.所得气体的质量
C.所得溶液的浓度 D.原硫酸的浓度
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
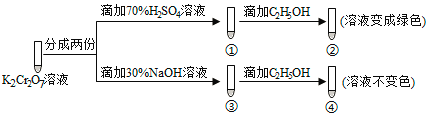
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I (1)某同学做如下实验,以检验反应中的能量变化。
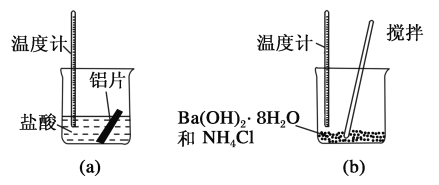
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;
(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2) 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,
③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
其中(用序号填空): 能设计成原电池的反应是____________________。
II(1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C. C2H4 和 C2H6
D.CH3CH2CH2CH3 和 CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是________;
属于同系物的是________; 属于同位素的是________。
(2) 两种粒子的核外电子排布相同,核电荷数不同,则它们可能是________。
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
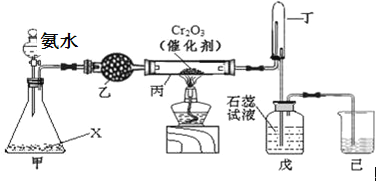
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,c和d位于同主族且原子序数相差8;基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,c原子s能级电子总数与p能级电子数相等,基态e原子的M层上有2个未成对电子且无空轨道。
(1)在a、b、c中,第一电离能由大到小排序为 (用元素符号表示);基态e原子的价层电子排布式为 。
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是 。已知(dab)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,1mol(dab)2分子含σ键的数目为 。
(3)写出一种与dab-互为等电子体的分子 (填化学式)。ac32-的中心原子杂化类型为 ;dc32-的空间构型为 。
(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为 g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA),晶胞中c粒子的配位数为 。
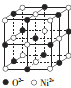
(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
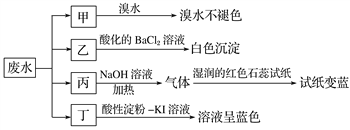
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高校曾以下列路线合成药物心舒宁(又名冠心宁),它是一种有机酸盐。
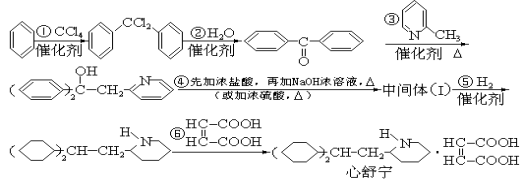
(1)心舒宁的分子式为 。
(2)中间体(Ⅰ)的结构简式是 。
(3)反应①~⑤中属于加成反应的是 (填反应代号).
(4)如果将⑤、⑥两步颠倒,则最后得到的是(写结构简式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g) ![]() 2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
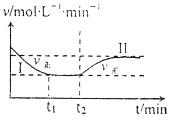
A.I、II两过程达到平衡时,平衡常数:KI<KII
B.I、II两过程达到平衡时,NH3的体积分数:I<II
C.I、II两过程达到平衡的标志:气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加H2和N2混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com