
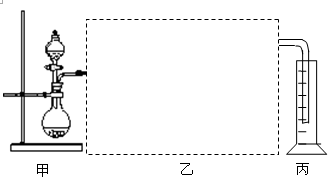
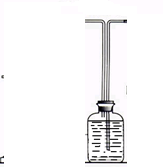
 ;
; ;
;

科目:高中化学 来源: 题型:
| A、①②⑤⑥ | B、①③⑥ |
| C、①③④⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
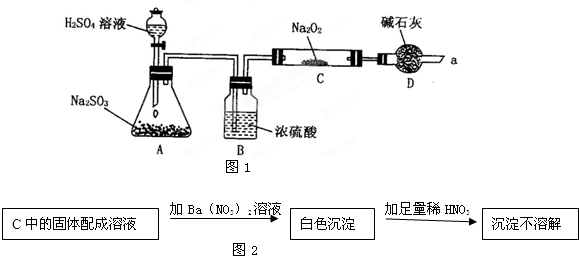
查看答案和解析>>
科目:高中化学 来源: 题型:
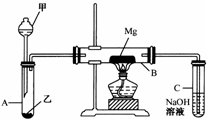 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.查看答案和解析>>
科目:高中化学 来源: 题型:
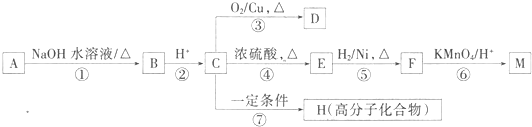
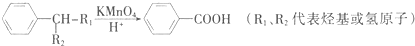
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将10.6gNa2CO3溶于100mL水中 |
| B、将28.6g Na2CO3?10H2O溶于少量水中,再用水稀释至100mL |
| C、将20mL5.0mol/L Na2CO3溶液用水稀释至100mL |
| D、在20mL5.0mol/L Na2CO3溶液中加入80mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
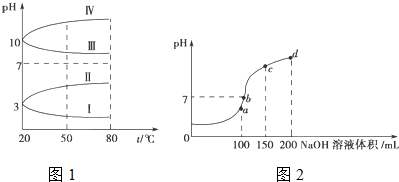
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B、常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C、带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D、对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com