
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为______,最后通入SO2析出硒单质。
(2)T℃时,向一恒容密闭容器中加入3mol H2和1mol Se,发生反应:H2(g) +Se(s) ![]() H2Se (g) ,△H<0
H2Se (g) ,△H<0
①下列情况可判断反应达到平衡状态的是__________(填字母代号)。
a.气体的密度不变 b.υ(H2)=υ(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②温度对H2Se产率的影响如图

550℃时H2Se产率的最大的原因为: _________。
(3)H2Se与CO2在一定温度和催化剂条件下发生反应:H2Se(g)+CO2(g)![]() COSe(g) +H2O(g)。该反应速率较低的原因除了温度和反应物的起始浓度外还可能____(填标号)。
COSe(g) +H2O(g)。该反应速率较低的原因除了温度和反应物的起始浓度外还可能____(填标号)。
A.催化剂活性降低 B.平衡常数变大
C.有效碰撞次数增多 D.反应活化能大
①在610 K时,将0.10 mol CO2与0.40 mol H2Se充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。反应平衡常数K1=___。
②若在620 K重复试验,平衡后水的物质的量分数为0.03。若在610 K绝热容器中重复实验,该反应的平衡常数K2___(填“>”“<”或“=”)K1。
(4)已知常温下H2Se的电离平衡常数Ka1=1.3×10-4、 Ka2=5.0×10-11,则NaHSe溶液呈_____(填“酸性”或“碱性”)。
(5)H2Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+ Se2-(aq)![]() CuSe(s)+S 2-(aq)的化学平衡常数K=____(保留2位有效数字)。
CuSe(s)+S 2-(aq)的化学平衡常数K=____(保留2位有效数字)。
【答案】2HCl +H2SeO4![]() H2SeO3+H2O+ Cl2↑ ad 低于550 ℃时,温度越高反应速率越快,H2Se的产率越大;高于550 ℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小 AD 2.8×10–3 < 碱性 1.6×1012
H2SeO3+H2O+ Cl2↑ ad 低于550 ℃时,温度越高反应速率越快,H2Se的产率越大;高于550 ℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小 AD 2.8×10–3 < 碱性 1.6×1012
【解析】
(1)此小题考查的是氧化还原反应方程式的书写。题中给出反应物,生成物,可根据得失电子守恒配平方程式;
(2)①根据化学平衡状态的本质和特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②根据温度对速率和平衡的影响分析。升高温度,速率加快;升高温度,平衡向吸热反应方向进行;
(3)此小题考查的是影响速率的因素。
A. 催化剂可以影响反应速率,催化剂的活性降低,反应速率减慢;
B.平衡常数与反应速率没有关系;
C.有效碰撞次数增多,化学反应速率越大;
D.化学反应中,所需活化能越小,需要提供的能量越小,反应速率越快,所需活化能越大,需要提供的能量越大,反应越难进行,反应速率越慢;
①先三段式解题,再根据平衡常数公式进行计算;
②根据温度对平衡的影响和平衡常数的影响分析;
(4)弱酸酸式盐溶液中,酸式根离子既存在电离平衡又存在水解水解,通过电离平衡常数计算比较二者的强弱来确定溶液的酸碱性;
(5) 根据反应写出K,结合溶度积分析得出平衡常数K=![]() 。据此解答。
。据此解答。
(1)根据题意,硒酸与盐酸共热生成亚硒酸,硒酸中的硒元素化合价由+6价降低到+4价生成亚硒酸,盐酸中的氯元素由-1价升高到0价生成氯气,化学反应方程式为2HCl +H2SeO4 ![]() H2SeO3+H2O+ Cl2↑。本小题答案为:2HCl +H2SeO4
H2SeO3+H2O+ Cl2↑。本小题答案为:2HCl +H2SeO4 ![]() H2SeO3+H2O+ Cl2↑。
H2SeO3+H2O+ Cl2↑。
(2)①a.从反应式中可以看出Se为固体,反应过程中气体的总质量是变化的,此反应在恒容容器总进行,根据![]() ,气体的密度是变化的,当气体的密度不再变化,说明反应达到平衡状态,故a正确;
,气体的密度是变化的,当气体的密度不再变化,说明反应达到平衡状态,故a正确;
b.若用不同的物质表示反应速率,若一个为正反应速率,另一个为反应速率,且速率之比等于化学计量数之比,可证明反应达到平衡状态,此选项为υ(H2)=υ(H2Se),二者速率之比为1:1,但没有表示出正、逆反应速率,不能证明反应达到平衡状态,故b错误;
c.相同条件下压强之比等于物质的量之比,此反应反应物与生成物中气体的物质的量之比为1:1,是反应过程中气体物质的量不变的反应,则反应过程中气体的压强也不变,则气体的压强不变,不能证明反应达到平衡状态,故c错误;
d.从反应式中可以看出Se为固体,反应过程中气体的总质量是变化的,且此反应反应物与生成物中气体的物质的量之比为1:1,是反应过程中气体的物质的量不变的反应,根据![]() ,气体的平均摩尔质量是变化的,当气体的平均摩尔质量不再变化,说明反应达到平衡状态,故d正确。答案选ad。
,气体的平均摩尔质量是变化的,当气体的平均摩尔质量不再变化,说明反应达到平衡状态,故d正确。答案选ad。
②对反应H2(g) +Se(s) ![]() H2Se (g) ,△H<0来说,低于550℃时,温度越高反应速率越快,H2Se的产率越大;高于550℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小。本小题答案为:低于550℃时,温度越高反应速率越快,H2Se的产率越大;高于550℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小。
H2Se (g) ,△H<0来说,低于550℃时,温度越高反应速率越快,H2Se的产率越大;高于550℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小。本小题答案为:低于550℃时,温度越高反应速率越快,H2Se的产率越大;高于550℃时,反应达到平衡,该反应为放热反应,温度越高平衡逆向移动H2Se的产率越小。
(3)A. 催化剂可以影响反应速率,催化剂的活性降低,反应速率减慢,故A正确;
B.平衡常数与反应速率没有关系,故B错误;
C.有效碰撞次数增多,化学反应速率越大,故C错误;
D.化学反应中,所需活化能越小,需要提供的能量越小,反应容易发生,反应速率越快,所需活化能越大,需要提供的能量越大,反应越难进行,反应速率越慢,故D正确。答案选AD。
①由题意设H2Se转化的物质的量为x,
H2Se(g)+CO2(g) ![]() COSe(g)+H2O(g)
COSe(g)+H2O(g)
起始时物质的量/mol 0.40 0.10 0 0
转化的物质的量/mol x x x x
平衡时的物质的量/mol 0.40-x 0.1-x x x
已知反应平衡后水的物质的量分数为0.02,则x/[(0.40x)+(0.10x)+x+x]=0.02,解得x=0.01,反应平衡常数K1=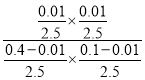 ≈2.8×10-3。本小题答案为:2.8×10-3。
≈2.8×10-3。本小题答案为:2.8×10-3。
②若在620 K重复试验,平衡后水的物质的量分数为0.03,水的物质的量分数增大,说明升高温度平衡正向移动,此反应为吸热反应。若在610 K绝热容器中重复实验,由于此反应为吸热反应,容器内温度降低,降低温度平衡逆向移,平衡常数减小,则K2<K1。本小题答案为:K2<K1。
(4)常温下H2Se的电离平衡常数Ka1=1.3×10-4、 Ka2=5.0×10-11,HSe-的水解平衡常数=![]() =
=![]() =7.7×10-11>Ka2,HSe-的水解程度大于电离程度,则NaHSe溶液呈碱性。本小题答案为:碱性。
=7.7×10-11>Ka2,HSe-的水解程度大于电离程度,则NaHSe溶液呈碱性。本小题答案为:碱性。
(5)反应CuS(s)+ Se2-(aq)![]() CuSe(s)+S 2-(aq)的化学平衡常数K=
CuSe(s)+S 2-(aq)的化学平衡常数K=![]() =
=![]() =
=![]() =
=![]() =1.6×1012,本小题答案为:1.6×1012。
=1.6×1012,本小题答案为:1.6×1012。


科目:高中化学 来源: 题型:
【题目】如图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液;图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. b电极为负极
B. 图1中电解质溶液的pH增大
C. a电极反应式为CH4-8e-+8OH-=CO2+6H2O
D. 图2中电解AlCl3溶液的总反应式为: 2AlCl3+6H2O ![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________。第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p区主族元素B.电负性都比镁大
C.第一电离能都比镁大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B元素只能形成[BF4]-配离子,由此可知决定配合物中配位数多少的因素是________________;[AlCl4]-的立体构型名称为______。
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是________________
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_________。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。若该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,则表示K原子半径的计算式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___和____。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸溶液浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是

A. 分子式为C20H14O4
B. 可以发生取代反应、加成反应、氧化反应
C. 含有的官能团有羟基、酯基
D. 1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。

则下列说法正确的是( )
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.A的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):

(1)设计装置A的目的是_____________________________________,为达此目的应进行的操作______________________________________________________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是____________________________________________________________;B中反应的离子方程式是_____________________________________________________。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是____________。
(4)D装置的作用是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质能刻蚀玻璃。
(1)A的分子式是________,写出A原子的价层电子排布式________。
(2)B分子的中心原子的杂化类型是________,分子空间构型是________,该分子属于________分子(填“极性”或“非极性”)。
(3)C的化学式是________,分子中含有的化学键类型是________。
(4)D物质的沸点比HCl的沸点高,其主要原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com