
【题目】关于化学能与其他能量相互转化的说法错误的是( )
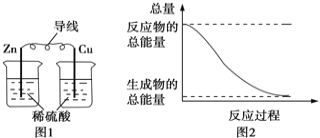
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为放热反应
C.中和反应中,生成物的总能量比反应物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与形成
【答案】A
【解析】
A.图1所示的装置没形成闭合回路,不能形成原电池;
B.反应物的总能量大于生成物的总能量,该反应为放热反应;
C.中和反应,反应物的总能量大于生成物的总能量;
D.化学反应时断键要吸收能量,成键要放出能量。
A. 图1所示的装置没形成闭合回路,不能形成原电池,没有电流通过,所以不能把化学能转变为电能,故A错误;
B. 图2所示的反应,反应物的总能量大于生成物的总能量,所以该反应为放热反应,故B正确;
C. 中和反应为放热反应,生成物的总能量比反应物的总能量低,故C正确;
D. 化学反应时断键要吸收能量,成键要放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故D正确;
故答案选:A。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
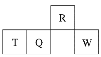
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q>W
C. 原子半径:T>Q>R
D. 单质T既可以与盐酸反应又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
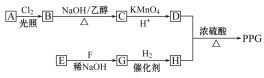
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质
④R1CHO+R2CH2CHO![]()
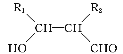
(1)根据信息①确定A的分子式为_____,结构简式为_________。
(2)G的化学名称是_____,所含官能团名称为________。
(3)G的同分异构体中,能与饱和NaHCO3溶液反应产生气体的有机物的结构简式为_______。
(4)化合物C的核磁共振氢谱中有____组峰。
(5)既能发生水解反应,又能发生银镜反应的G的同分异构体有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
![]()
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可作光导纤维。
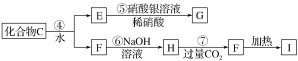
按要求回答下列问题:
(1)C的化学式为________;X的化学式为________。
(2)写出下列方程式:
反应②的化学方程式_________________________________________________;
反应⑦的离子方程式_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
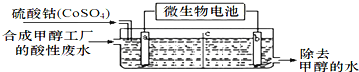
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
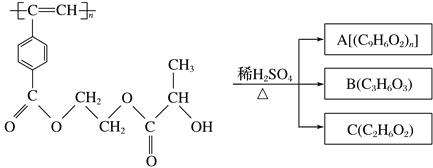
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是新型、高效、多功能的绿色水处理剂。
(1)配平化学方程式并标出电子转移方向和数目:
_____Fe(OH)3+ NaClO+ NaOH→ Na2FeO4+ NaCl+ H2O
反应中氧化剂是_____,被还原的元素是_____;
(2)若上述反应中转移0.3mol电子,则消耗NaOH的物质的量为_____;
(3)高铁酸钠和二氧化氯都是高效杀菌消毒剂,消毒效率(单位物质的量转移的电子数)高铁酸钠是二氧化氯的_____倍;
(4)含Fe3+的溶液与NaHCO3混合,产生红褐色沉淀,同时有无色无味的气体生成,用平衡移动原理解释上述现象_____;
(5)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中c(CO32﹣)的大小关系为_____(用编号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实相符的是

A.若a为Cl2,b为滴有酚酞的NaOH溶液,可出现红色喷泉
B.若a为CO2,b为NaHCO3溶液,可出现无色喷泉
C.若a为HCl,b为AgNO3溶液,可出现白色喷泉
D.若a为NH3,b为水(预先滴加少量石蕊溶液),可出现红色喷泉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com