
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。

i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
【答案】 4I-+O2+4H+=2I2+2H2O 验证Cl-是否影响KI与O2的反应 其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性减弱 pH=10的KOH溶液 电流表指针偏转,烧杯b的溶液颜色变深 3I2+6OH-=IO3-+5I-+3H2O 中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量” 碘单质使溶液颜色发生变化 pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-
【解析】(1)实验②是在酸性条件下氧气将碘离子氧化生成碘单质,碘单质遇淀粉使溶液变蓝,其反应的离子方程式是:4I-+O2+4H+=2I2+2H2O;(2)实验②加入盐酸电离产生的H+和Cl-,通过实验③可以排除是否为Cl-离子对于KI与O2的反应的影响;(3) 其他条件相同时,CH3COOH是弱电解质,溶液中c(H+)较盐酸小,O2的氧化性随溶液pH的增大逐渐减弱,故实验④比②溶液颜色浅;(4) i.甲同学提出猜想“pH=10时O2不能氧化I-”,故烧杯a中的溶液可以为pH=10的KOH溶液;ii.通入O2后,若电流表指针偏转,烧杯b的溶液颜色变深,则pH=10时O2也能氧化I-,此猜想不成立。Ⅱ.碱性条件下碘单质发生歧化反应生成IO3-和I-,则开始滴入时遇淀粉变蓝,后碘消耗而褪色,其离子反应方程式为:3I2+6OH-=IO3-+5I-+3H2O ;(5)实验①的现象产生的原因可能是中性条件下,O2的氧化性比较弱,该反应速率慢,短时间内难以生成“一定量”的碘单质使溶液颜色发生变化;实验⑥的现象产生的原因可能是pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某单烯烃A(C8H16)可以发生如下图示的转化,回答下列问题:

已知: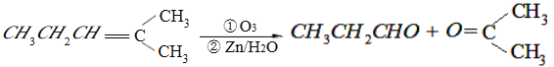
(1)B的分子式为___________________,D中含有官能团的名称___________________。
(2)B无银镜反应, D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),请写出E的结构简式____________________________________,D→E的反应类型___________________________。
(3)写出C→F的化学方程式_________________________________。
(4)H的同分异构体中,满足下列要求的结构一共有____________种(不考虑立体异构,包括H本身)
①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物
(5)已知: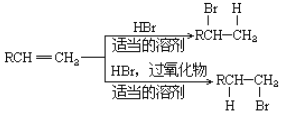 。
。
请写出由C制备2-丙醇的合成路线_____________________(无机原料任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的转化: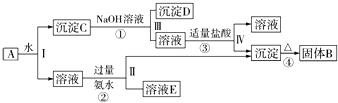
(提示:沉淀C可能是混合物,①步骤中所用NaOH溶液是过量的)依据以上信息回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式;固体B;溶液E .
(3)写出④反应的化学方程式④;①、②、③、反应的离子方程式①;②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装罝如下图所示。请回答:

(1)装置A中分液漏斗内的物质是________________ 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是___________________。
(3)实验过程中通入足量的SO2,请设计一个实验方案,验证SO2与FeCl3溶液反应的主要产物(H+无需检验)______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A. Na与O2 B. Fe和FeCl3 C. NaOH与CO2 D. Cu与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列说法正确的是( )
A.Si常用做信息高速公路的骨架—光导纤维的主要材料
B.近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
C.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是()
A. 含最高价元素的化合物,一定具有强氧化性
B. 阳离子只有氧化性,阴离子只有还原性
C. 化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原。
D. 失去电子多的还原剂还原性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com