
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装罝如下图所示。请回答:

(1)装置A中分液漏斗内的物质是________________ 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是___________________。
(3)实验过程中通入足量的SO2,请设计一个实验方案,验证SO2与FeCl3溶液反应的主要产物(H+无需检验)______________________________________________。
【答案】 浓硫酸 没有打开分液漏斗的上口玻璃塞(或分液漏斗上口玻璃塞上的凹槽没有与分液漏斗上的小孔连通或导管发生堵塞),导致无法与外界大气连通 取少量反应后的溶液于试管中,滴加KSCN溶液,无明显现象,加入足量H2O2或氯水,溶液变血红色,则产物有Fe2+生成;另取少量反应后的溶液,滴加BaCl2溶液,若产生白色沉淀,则有SO42-生成
【解析】(1)根据题意可知,装置A为SO2的发生装置,实验室制备SO2常用浓硫酸与Na2SO3固体反应来制备,故分液漏斗中为浓硫酸;
答案为:浓硫酸;
(2)分液漏斗液体不能顺利流下,是因为分液漏斗中压强大于外界压强。在滴加液体之前要先打开分液漏斗上口玻璃塞或者使玻璃塞上的凹槽与分液漏斗上的小孔对齐。
故答案为:没有打开分液漏斗的上口玻璃塞或分液漏斗上口玻璃塞上的凹槽没有与分液漏斗上的小孔连通或导管发生堵塞,导致无法与外界大气连通。
(3)SO2有强还原性,Fe3+有强氧化性,二者发生氧化还原反应,反应离子方程式为:
2Fe3++ SO2+2H2O=2Fe2++ SO42-+4 H+。检验Fe2+生成的实验方法为:取少量反应后的溶液于试管中,滴加KSCN溶液,无明显现象,加入足量H2O2或氯水,溶液变血红色,则产物有Fe2+生成;检验SO42-的生成实验方法为:取少量反应后的溶液,滴加BaCl2溶液,若产生白色沉淀,则有SO42-生成。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
A.盐酸,水煤气,醋酸,干冰B.冰醋酸,盐酸,硫酸钠,乙醇
C.苛性钠,石灰石,铁,硫酸钡D.胆矾,漂白粉,氯化钾,氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是 ( )
A. H2(气)+I2(气) ![]() 2HI(气)
2HI(气)
B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C. 2SO2(气)+O2(气) ![]() 2SO3(气)
2SO3(气)
D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然气的主要成分,以A为原料可获得多种有机物,其相互转化关系如图。己知B有刺激性气味.是一种常见的室内空气污染物,烃D在标准状况下的密度为1.16g L-1,B、E能发生银镜反应, G为有浓郁香味,不易溶于水的油状液体。
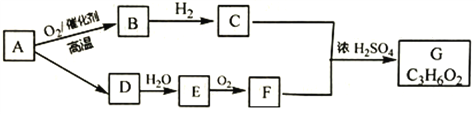
请回答:
(1)有机物F中含有的官能团名称是_______________________。
(2)B→C的反应类型是_________________。
(3)写出有机物A转化为B的化学方程式____________________________________。
(4)下列说法正确的是__________。
A.有机物B和E互为同分异构体
B.有机物D、E都能使酸性高锰酸钾溶液褪色,且反应类型相同
C.有机物G在碱性条件下可完全水解,该反应称为皂化反应
D.有机物C、F、G可用饱和Na2CO3溶液鉴别
E.等质量的B和F完全燃烧消耗相同量的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”是东晋葛洪提取青蒿素的过程,属化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与所得结论一致的是
实验操作 | 现象 | 结论 | |
A | 向25ml 沸水中滴加5~6滴 FeCl3饱和溶液,持续加热煮沸 | 变为红褐色 | 最终制得 Fe(OH)3 胶体 |
B | 欲收集酯化反应生成的乙酸乙酯并分离提纯,将导管伸入饱和Na2CO3溶液的液面下,再用分液漏斗分离 | 溶液分层,上层为无色油状液体 | 乙酸乙酯不溶于饱和Na2CO3 溶液,且密度比水小 |
C | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
D | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: I3- I2+I- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。

i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液的工艺流程如下:

(1)“沉淀”中生成CuI的离子方程式为___________________。
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_____,分析原因___________。

(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(4)操作Ⅰ包括______,冰水洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用硝酸为原料生产亚硝酸钠的工艺流程如下,等物质的量的NO和NO2恰好能被Na2CO3溶液在吸收塔中完全吸收生成NaNO2 . 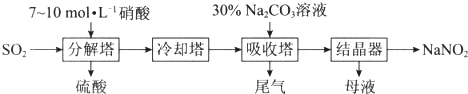
(1)吸收塔中发生反应的化学方程式是 .
(2)分解塔中需要严格控制硝酸的浓度,目的是 .
(3)向母液中加入硝酸,发生反应3NaNO2+2HNO3=3NaNO3+2NO↑+H2O,经结晶可制得副产品NaNO3 . 对该过程中产生的NO的处理方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com