
| A、②>④>③>① |
| B、②>④>①>③ |
| C、③>①>②>④ |
| D、①>④>③>② |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| A、甲烷 | B、乙烯 | C、乙烷 | D、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
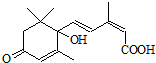 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在新制的氯水中加入NaOH溶液至中性时,满足c(Na+)=c(ClO-)+c(HClO) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,水解平衡常数Kh增大,而Kw不变 |
| C、常温下,pH=11的某碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合,则:2c(H+)-2c(OH)=C(CH3COO)-C(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
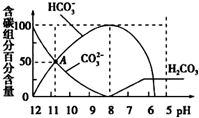 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、当加入20 mL盐酸时,混合溶液的pH约为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2A(l)+B (l)═2C(g)△H1 |
| B、2A(g)+B (g)═2C(g)△H2 |
| C、2A(g)+B ( g )═2C(l)△H3 |
| D、2A(l)+B (l)═2C(l)△H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com