
【题目】X、Y、W、Z为四种短周期主族元素,在周期表中的位置如图所示,W原子的最外层电子数与电子层数相同,下列说法正确的是
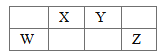
A. X是形成化合物种类最多的元素
B. W、X、Y的原子半径依次增大
C. W的最高价氧化物对应的水化物可溶于X的最高价氧化物对应的水化物的溶液
D. X的最简单气态氢化物的稳定性强于Y的最简单氢化物的稳定性
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是最宝贵的资源之一。下列表述正确的是( )
A.40℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中元素和化合物的叙述错误的是
A. 休眠的种子比萌发的种子结合水含量高
B. 镁是参与叶绿素合成的微量元素
C. 蛋白质和脂质是所有细胞共有的化合物
D. 磷脂和胆固醇均属于组成动物细胞膜的脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种短周期主族元素,其原子半径随原子序数的变化如图。已知W是地壳中含量最高的元素;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
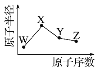
A. 对应的简单离子的半径:X<W
B. 对应的简单气态氢化物的稳定性:Y>Z
C. 元素X、Z分别与W能形成多种化合物
D. Z的最高价氧化物对应的水化物具有强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是________________________。
(2)试剂a是____________________。
(3)反应③的化学方程式:_________________________________________________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________________________。
(5)反应④的反应类型是____________________________。
(6)反应⑤的化学方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙烯分子中的化学键描述正确的是
A. 碳原子的三个sp2杂化轨道与其它原子形成三个σ键
B. 每个碳原子的未参加杂化的2p轨道形成σ键
C. 每个碳原子的sp2杂化轨道中的其中一个形成π键
D. 碳原子的未参加杂化的2p轨道与其它原子形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
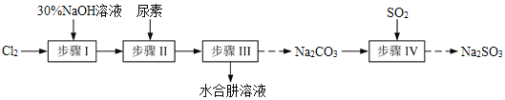
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
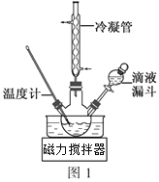
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
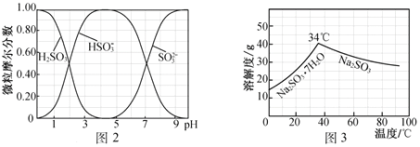
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
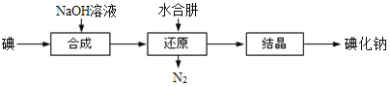
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com