
����Ŀ����֪ij���������к���NaCl���ʣ�Ϊ�ⶨ�����д��������������������ͼ�е�װ�ý���ʵ�顣
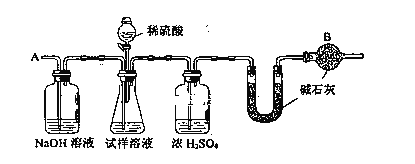
��Ҫʵ�鲽�����£�
�� ��ͼ��װ������������װ�õ�������
�� ��a g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ
�� ����ʢ�м�ʯ�ҵ�U�ܵ��������õ�b g
�� �ӷ�Һ©������6mol��L��1�����ᣬֱ�����ٲ�������ʱΪֹ
�� �ӵ���A����������һ�����Ŀ���
�� �ٴγ���ʢ�м�ʯ�ҵ�U�ܵ��������õ�c g
�� �ظ�����ݺ͢IJ�����ֱ��U�ܵ������������䣬Ϊd g
��ش������й����⣺
(1)����������ƽ������Ʒʱ�������ƽ��ָ������ƫת��˵��________________��
(2)װ���и����B��������______________________________________________��
(3)�������Һ©���е����ỻ��Ũ����ͬ�����ᣬ���ԵĽ��_________��(ѡ��ƫ�ߡ�ƫ�ͻ�)��
(4)����ݵ�Ŀ����__________________________________________��
(5)����ߵ�Ŀ����__________________________________________��
(6)�����д�������������ļ���ʽΪ__________________________��
(7)д��������ϡ���ᷴӦ�����ӷ���ʽΪ________________________��
���𰸡���Ʒ�أ������� ��ֹ�����е�CO2��ˮ������U���� ƫ�� �ѷ�Ӧ������CO2ȫ������U�ι��� �жϷ�Ӧ������CO2�Ƿ�ȫ���ų�������U�ι��еļ�ʯ������ ![]() ��100% CO32-��2H+= CO2��+H2O
��100% CO32-��2H+= CO2��+H2O
��������
(1)������ƽ����ʱ�������������ԭ���ǣ�
(2)���ڿ�����Ҳ�ж�����̼��ˮ�֣������B�����þ��Dz������ǽ���ģ�
(3)��������Ļӷ��Կ��ǣ�
(4)���ڷ�Ӧ��������ƿ�д����ж�����̼������һ�����Ŀ�������Ϊ���������ǵģ�
(5)����Ϊ�˽�������̼ȫ���Ϲ�ȥ��
(6)����U�ܵ��������������������ɵĶ�����̼�����������ݶ�����̼���������̼���Ƶ�����������̼���Ƶ�����������Ʒ�������ɡ�
(7) ���������ᷴӦ���������ơ�������̼��ˮ�������������Ϊǿ����ʣ�д��ѧʽ��
(1)���ڳ���ʱ�������룬����ƫ˵����Ʒ�أ������
(2)U���еļ�ʯ����Ϊ�����շ�Ӧ���ɵĶ�����̼����������Ҳ���ڶ�����̼�������B�����þ��Ƿ�ֹ�����еĶ�����̼��ˮ�ֽ���U�ܣ��Խ��������
(3)����������лӷ��ԣ�Ҳ�����Ŷ�����̼����U�ܣ�������Ϊ�Ƕ�����̼�����Զ�����̼������ƫ�������̼���Ƶ�����Ҳ��ƫ��ģ����Խ����ƫ�ߣ�
(4)���ڷ�Ӧ��������ƿ�д����ж�����̼������һ�����Ŀ������ǽ������Ķ�����̼��ȫ����U�ܣ�
(5)ֱ��U�ܵ������������䣬˵��������̼�Ѿ���ȫ���ŵ�U���У�����ߵ�Ŀ���ǣ��жϷ�Ӧ������CO2�Ƿ�ȫ���ų�������U�ι��еļ�ʯ�����գ�
(6)����Ҫ̼���Ƶ�����Ϊm��
Na2CO3+H2SO4�TNa2SO4+H2O+CO2��
106 44
m db
�б���ʽ��ã�m=![]() �����������д�������������ļ���ʽ=
�����������д�������������ļ���ʽ=![]() ��100%��
��100%��
(7)���������ᷴӦ���������ơ�������̼��ˮ�������������Ϊǿ����ʣ�д��ѧʽ�������ӷ���ʽΪCO32-��2H+= CO2��+H2O��


 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ���ǣ� ��
A.��FeCl3��Һ��ʴͭ��·�壺Cu+2Fe3+��Cu2++2Fe2+
B.Na2O2��H2O��Ӧ�Ʊ�O2��Na2O2+H2O��2Na++2OH-+O2��
C.����������ˮ�Ʊ������Cl2+H2O��2H++Cl-+ClO-
D.�������ᷴӦ��2Fe + 6H+��2Fe3++3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ȼ������Ҫ�ɷ�,��һ�ָ�Ч���ͺġ���ȾС�������Դ������˵����ȷ����( )
�ټ�����һ����������ṹ�ķ���
�����ʵ���1��1�ļ�������������ȡ����Ӧʱ,������ֻ��CH3Cl��HCl
��0.5 mol������ȫȼ��ʱ�����������Ϊ1 mol
��1 mol����ȫ������CCl4���������2 mol����
A.�٢�B.�٢�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع輰�仯�����˵����ȷ���ǣ� ��
A.�մɡ�������ˮ�������������������
B.�����������Σ������ڼ���Թ����ƿ��Ա����ھ���ĥ�ڲ��������Լ�ƿ��
C.��![]() ��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��
��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��![]()
D.��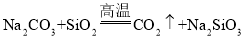 ��֪�����������ǿ��̼��
��֪�����������ǿ��̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ��ͼ��ʾ������ԭ��ΪFe3����Cr2��![]() Fe2����Cr3��������˵��һ����ȷ����
Fe2����Cr3��������˵��һ����ȷ����
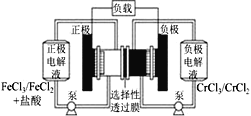
A.�ŵ�ʱ�������ĵ缫��ӦʽΪCr2����e��=Cr3��
B.��س��ʱ�������ĵ缫��ӦʽΪFe2����e��=Fe3��
C.��طŵ�ʱ��Cl���������Ҵ���ѡ������Ĥ������
D.�ŵ�ʱ����·��ÿ����0.1 mol���ӣ�Cr3��Ũ������0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ҵӻ��ʳ�������![]() �м�����Ϊ
�м�����Ϊ![]() �����ʣ����ⶨ��������������ˮ����ˮ����
�����ʣ����ⶨ��������������ˮ����ˮ����![]() ��
��![]() ����������ʽ���ڣ�ֲ��ĸ�ϵ������
����������ʽ���ڣ�ֲ��ĸ�ϵ������![]() ������������ʱ��������һ�����ư���
������������ʱ��������һ�����ư���![]() ���ӣ�
���ӣ�![]() ���Ӳ��ܱ�ֲ�����ա�
���Ӳ��ܱ�ֲ�����ա�
��ش��������⣺
![]() ��
��![]() �Ĺ�ϵ��ȷ���� ______
�Ĺ�ϵ��ȷ���� ______ ![]() �����
�����![]() ��
��
A.ͬ�ֵ���![]() ͬλ��
ͬλ��![]() ͬ���칹��
ͬ���칹��![]() ͬ��������
ͬ��������
![]() ______
______ ![]() ������������������
������������������![]() �Ͳ�ľ�һ��ʩ�á�
�Ͳ�ľ�һ��ʩ�á�
![]() ��֪����
��֪����![]() ����167kJ����������1molN
����167kJ����������1molN![]() N�ų�
N�ų�![]() ��������д��
��������д��![]() ����ת��Ϊ
����ת��Ϊ![]() ���Ȼ�ѧ����ʽ�� ______ ��
���Ȼ�ѧ����ʽ�� ______ ��
![]() ��֪���ס�
��֪���ס�![]() ��
��![]() �Ŀռ乹�;�Ϊ�����壬
�Ŀռ乹�;�Ϊ�����壬![]() �ĽṹʽΪ
�ĽṹʽΪ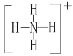 ������
������![]() �ĽṹʽΪ
�ĽṹʽΪ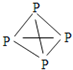 ���뻭��
���뻭��![]() �Ľṹʽ ______ ��
�Ľṹʽ ______ ��
![]() ��֪Һ���д�����ƽ��
��֪Һ���д�����ƽ��![]() ����ѧ����Һ���м����������
����ѧ����Һ���м����������![]() ���������ˮ����ʹҺ���е�
���������ˮ����ʹҺ���е�![]() ����
����![]() ���Ӻ���һ�ֵ������壬��д��Һ����������路�Ӧ�Ļ�ѧ����ʽ�� ______ ��
���Ӻ���һ�ֵ������壬��д��Һ����������路�Ӧ�Ļ�ѧ����ʽ�� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() ��˵������ȷ����
��˵������ȷ����
A. ����ԭ�Ӷ�������ͬһƽ����
B. ���ֻ������9��̼ԭ����ͬһƽ����
C. ��7��̼ԭ�ӿ�����ͬһֱ����
D. ��������5��̼ԭ����ͬһֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊһ�ֳ���ҩ�����н�����ʹ��Ч����ʵ�����Ʊ���������ʱ�������ñ�������������������ȡ���÷�Ӧ���ȣ�
�ܶȣ�g/mL�� | ��Է������� | ��ɫ��״̬ | �ܽ��� | |
���� | 1.04 | 93 | ��ɫ��״Һ�� | ����ˮ�� �������Ҵ������� |
������ | 1.08 | 102 | ��ɫ��Һ�� | ��ˮ������Ӧ�������� |
�������� | 135 | ��ɫƬ״���壬 �۵� 114�� | ��������ˮ���������� ˮ���Ҵ������� |
ʵ�鲽��
��ȡ5.00 mL����������100 mL��ƿ�У�����20 mLˮ������ҡ�·�������6.00 mL ��������������ȡ����н������������ò���������״�����飬�ٳ�ֽ��裻
�ڷ�Ӧ��ȫ��ʱ�ѷ�Ӧ�����ת�Ƶ��ձ��У���ȴ���ˣ�ϴ�ӣ��ô������������壻
�۽��ֲ�Ʒת����150 mL�ձ��У���������ˮ���Ƴ� 80 ��ı�����Һ���ټ������20%��ˮ������Ӱ����̿�������½���Һ���3��5 min��_______����ȴ�ᾧ�����ˡ�ϴ�ӡ����ɵ�����������Ʒ6.2 g��
��ش�
��1����Ӧ�¶ȹ��ᵼ�±����ӷ������в����ɿ��Ʒ�Ӧ�¶ȣ���ֹ��Ӧ�¶����߹������______��
A ��20 mLˮ B ��ҡ�·�������6.0 mL������
C ����������״������ D ��ֽ���
��2���ڲ�����жԴֲ�Ʒ����ϴ����Ҫ�õ����²�����
a ����ϴ�Ӽ�����û���壻b ϴ�Ӽ�����ͨ����c ��Сˮ��ͷ��d ����ˮ��ͷ�� e �ظ� 2��3 �Ρ�
������ϲ���������ȷ������__________��
��3������ۼ������ 20%��ˮ��Ŀ����________�����ߴ��IJ���������_________��
��4������˵������ȷ����______��
A ����̿������ɫ���ʣ�������߲���
B ��ȴʱ��������ȴ�ȱ�ˮԡ��ȴ���õ������������ڳ���
C ��������ͼװ�ã�Ϊ��ֹ����������ʱ���ȹر�ˮ��ͷ�������a
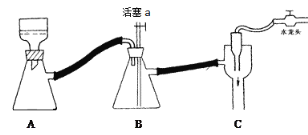
D ��Ʒ�ɷ��ڱ�����������ˮԡ��ɣ���ɺ��ͨ��������Ʒ�۵��жϲ�Ʒ����
��5����ʵ��IJ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����е����� CaCl2��MgCl2 �� Na2SO4,�������£�
![]()
�����й�˵���У�����ȷ����( )
A. ��ȥ Mg2+����Ҫ��Ӧ�� Mg2++ 2OH-=Mg(OH)2��
B. �Լ���һ������Na2CO3��Һ
C. ���� SO42-�Ƿ������ȡ������Һ����ϡ�����ữ���ټ� BaCl2 ��Һ
D. ��Һ��ϡ����ʱֻ������Ӧ��H+ +OH- =H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com