
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
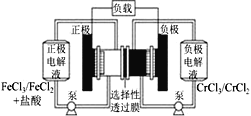
A.放电时,正极的电极反应式为Cr2+-e-=Cr3+
B.电池充电时,阴极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从正极室穿过选择性透过膜移向负极室
D.放电时,电路中每流过0.1 mol电子,Cr3+浓度增加0.1 mol·L-1
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮氧化物等物质,造成严重的环境污染。煤的干馏是提高煤的利用率、生产重要化工原料、降低污染物排放量的有效措施之一。某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如图所示,请回答有关问题:

(1)煤干馏的条件是_______。
(2)盛有冷水的烧杯的作用是__________________
(3)实验后检验有粗氨水生成的操作是___
(4)已知CO不能使溴水褪色,若将从具支试管支管口处逸出的气体通入溴水中,发现溴水褪色,则说明煤的干馏产生了_______________________
(5)点燃尾气,火焰的颜色为________________________
(6)从煤焦油中分离出苯、甲苯、二甲苯的实验方法是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种光伏材料中间体。工作室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题
(1)B所含官能团名称为___________。
(2)由B生成C和E生成F的反应类型分别为___________、___________。
(3)D的结构简式为___________。
(4)由A生成B的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,符合要求的X的结构有___________种,写出其中一种结构简式___________。
(6)根据已有知识并结合相关信息,写出以乙醇为原料合成 CH3CH2CH2COOH的合成路线(无机试剂在用)(合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH ______________________________________________。
CH3CH2OH ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是____。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?___。应增加哪些措施防止污染______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是________。(填化学式)
(2)工艺师常用氢氟酸来雕刻玻璃,发生反应的化学方程式为_________。
(3)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,用氧化物形式表示为________。
(4)高纯度单晶硅可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
写出步骤①的化学方程式: _______。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),提纯SiHCl3主要操作的名称是________。
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,还可能使产品中混有杂质________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
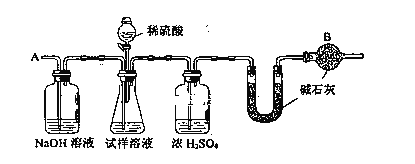
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请回答下列有关问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________________。
(2)装置中干燥管B的作用是______________________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________。(选填偏高、偏低或不变)。
(4)步骤⑤的目的是__________________________________________。
(5)步骤⑦的目的是__________________________________________。
(6)试样中纯碱的质量分数的计算式为__________________________。
(7)写出纯碱与稀硫酸反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HI常用作有机反应中的还原剂,受热会发生分解反应。已知443℃时:2HI(g)![]() H2(g)+I2(g) △H=+12.5kJ·mol-1向1L密闭容器中充入1mol HI,443℃时,体系中c(HI)与反应时间t的关系如图所示。下列说法中,正确的是( )
H2(g)+I2(g) △H=+12.5kJ·mol-1向1L密闭容器中充入1mol HI,443℃时,体系中c(HI)与反应时间t的关系如图所示。下列说法中,正确的是( )

A.0~20min内的平均反应速率可表示为v(H2)=0.0045mol·L-1·min-1
B.升高温度,再次平衡时,c(HI)>0.78mol·L-1
C.该反应的化学平衡常数计算式为![]()
D.反应进行40 min时,体系吸收的热量约为0.94kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
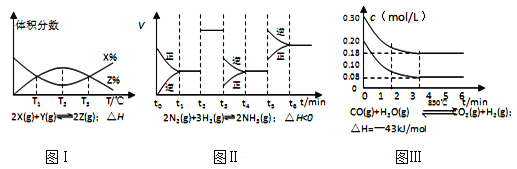
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com