
【题目】下列指定反应的离子方程式正确的是
A.Fe(OH)3 溶于HI溶液: 2Fe(OH)3+6H++2I- =2Fe2++I2+6H2O
B.向NaAlO2溶液中通入过量CO2: 2![]() +CO2+3H2O = 2Al(OH)3↓+
+CO2+3H2O = 2Al(OH)3↓+![]()
C.向[Ag(NH3)2]OH溶液中加入足量盐酸生成白色沉淀: [Ag(NH3)2]+ + Cl-= AgC1↓+ 2 NH3↑
D.向K2MnO4溶液中加入醋酸生成KMnO4和MnO2: 3![]() + 4H+= MnO2↓+ 2
+ 4H+= MnO2↓+ 2![]() +2H2O
+2H2O
【答案】A
【解析】
A.Fe(OH)3 溶于HI溶液,二者发生氧化还原反应生成亚铁离子、碘单质和水,离子反应为:2Fe(OH)3+6H++2I- =2Fe2++I2+6H2O,故A正确;
B. 向NaAlO2溶液中通入过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,正确的离子方程式为:AlO2+CO2+2H2O═Al(OH)3↓+HCO3,故B错误;
C.向[Ag(NH3)2]OH溶液中加入足量盐酸生成白色沉淀,离子方程式:[Ag(NH3)2]++OH+3H++Cl=AgCl↓+2NH4++H2O,故C错误;
D.向K2MnO4溶液中加入醋酸生成KMnO4和MnO2,反应的离子方程式为:3MnO42+4CH3COOH═MnO2↓+2MnO4+2H2O+4CH3COO,故D错误;
故选:A。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】国家有色金属工业“十三五”发展规划要求,再生铅占铅总量比重到2020年升至45%。从废旧铅蓄电池中回收的工艺流程为![]() ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是
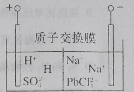
A.电解过程中阳极附近pH明显增大
B.阴极电极反应式为![]() +2e-=Pb+4Cl-
+2e-=Pb+4Cl-
C.电路中通过2 mol电子,阴极可得207 g铅
D.Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在电极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-。
已知:正极反应式:O2-4e-=2O2-。
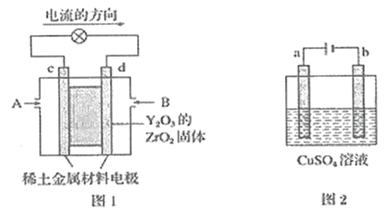
则:c电极的名称为__,d电极上的电极反应式为__。
(2)如图2所示,用惰性电极电解100mL0.5molL-1CuSO4溶液,a电极上的电极反应式为__,若a电极产生56mL(标准状况)气体,则所得溶液的pH=_(不考虑溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
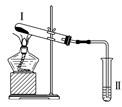
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拉曼光谱证实,![]() 在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中
在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中![]() 、
、![]() 、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
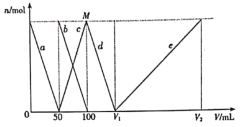
A.![]() 、
、![]() 和[Al(OH)4]-在水溶液中可大量共存
和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中![]() 与
与![]() 的物质的量之比为1:1
的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为amol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则( )

A.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
B.x的取值范围是0<x<![]()
C.A点横坐标的值随x发生变化
D.x=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_________________,其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为_____________(用元素符号表示)。
②N、O两元素的的第一电离能由大到小的顺序为___________(用元素符号表示)。
③SO42-中S原子的杂化方式为___________,VSEPR模型名称为___________________。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+。该阴离子的电子式为_____,σ键和π键的数目之比为______________。其空间构型为__________。
(4)K3[Fe(CN)6]晶体中配离子的配位体为_____(用化学符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
B. C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
C. H2O、NH3、CH4分子中的O、N、C原子均采取sp3杂化
D. 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com