
【题目】在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为amol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则( )

A.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
B.x的取值范围是0<x<![]()
C.A点横坐标的值随x发生变化
D.x=![]()
【答案】D
【解析】
A.Al3+的物质的量为a mol,最终消耗氢氧化钠是4amol,根据电荷守恒,n(Mg2+)=(1.1-1.5a)mol,消耗氢氧化钠是(2.2-3a)mol,共消耗氢氧化钠是(a+2.2)mol,所以若B点横坐标为200mL时,c(NaOH)=![]() mol·L-1,故A错误。
mol·L-1,故A错误。
B.溶液中Al3+的物质的量为a mol,由电荷守恒可知,Mg2+的物质的量为(1.1-1.5a)mol,则x=![]() ,根据电荷守恒a<
,根据电荷守恒a<![]() ,解得x的取值范围是:0<x<
,解得x的取值范围是:0<x<![]() ,故B错误;
,故B错误;
C.因为溶液中氯离子、硫酸根离子物质的量一定,A点时镁离子、铝离子完全被转化为沉淀,则溶液中的溶质转化为氯化钠、硫酸钠,所以A点横坐标的值不会随x发生变化,故C错误;
D.Al3+的物质的量为a mol,根据电荷守恒:n(Cl-)+2n(SO42-)=2n(Mg2+)+3n(Al3+),解得2n(Mg2+)=0.6mol+1.6mol-3amol=(2.2-3a)mol,n(Mg2+)=(1.1-1.5a)mol,所以Al3+的物质的量与混合溶液中离子总物质的量的比值为x,即x=![]() =
=![]() ,故D正确;
,故D正确;
故选D。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是
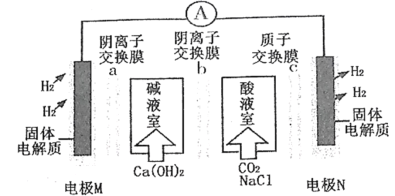
A.电子由电极M经外电路流向电极N
B.在碱液室可以生成NaHCO3、Na2CO3
C.放电一段时间后,酸液室溶液pH减小,碱液室pH增大
D.Cl-通过阴离子交换膜b移向碱液室,H+通过质子交换膜c移向N极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下体积为1mL、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为VmL,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
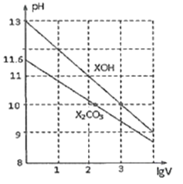
A.VOH为弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.当lgV=3时,XOH溶液中由水电离的OH-的浓度为10-10mol/L
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Fe(OH)3 溶于HI溶液: 2Fe(OH)3+6H++2I- =2Fe2++I2+6H2O
B.向NaAlO2溶液中通入过量CO2: 2![]() +CO2+3H2O = 2Al(OH)3↓+
+CO2+3H2O = 2Al(OH)3↓+![]()
C.向[Ag(NH3)2]OH溶液中加入足量盐酸生成白色沉淀: [Ag(NH3)2]+ + Cl-= AgC1↓+ 2 NH3↑
D.向K2MnO4溶液中加入醋酸生成KMnO4和MnO2: 3![]() + 4H+= MnO2↓+ 2
+ 4H+= MnO2↓+ 2![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是
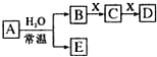
A.若X是Na2CO3,C为CO2,则A一定是氯气,此时D和E不反应
B.若X是CO2,B和D的反应是OH-+![]() =
=![]() +H2O,则E一定能还原Fe2O3
+H2O,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献,![]() 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________形。
(2)![]() 中
中![]() 的配位数为4。
的配位数为4。
①配体中![]() 原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
②![]() 的立体构型是________;与
的立体构型是________;与![]() 互为等电子体的分子和离子为________(各写一种)。
互为等电子体的分子和离子为________(各写一种)。
(3)![]() 是钴的重要化合物。
是钴的重要化合物。![]() 键角小于
键角小于![]() 的键角,原因是________。
的键角,原因是________。
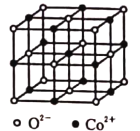
(4)一氧化钴的晶胞如图所示,在每个![]() 的周围与它距离最近的
的周围与它距离最近的![]() 共有________个,若
共有________个,若![]() 晶体的密度为
晶体的密度为![]() ,则晶体中
,则晶体中![]() 与
与![]() 之间的最小距离为________
之间的最小距离为________![]() 。(用含
。(用含![]() 和
和![]() 的代数式表示。
的代数式表示。![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2A在溶液中存在如下电离:H2A=H++HAˉ,HAˉ![]() H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
A.![]()
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ)
D.1L溶液中的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。
(1)用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1248 kJ/mol
反应CH4(g)+2NO2(g)= N2(g) +CO2(g)+2H2O(l) △H=________kJ/mol
(2)氮氧化物可用碱溶液吸收。NO和NO2混合气体按一定比例被NaOH溶液完全吸收生成NaNO2和H2O,写出该反应的化学方程式________;若反应过程中消耗NaOH的物质的量为3 mol,则理论上被吸收的NO和NO2混合气体的总体积在标准状况下为________L。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
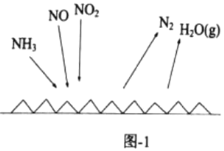
①由图1可知SCR技术中的还原剂为________。
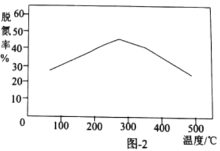
②一定时间内,用Fe作催化剂,氨气按一定的比例催化还原氮氧化物时,不同温度下的脱氮率如图2所示,温度高于300℃时,脱氮率随温度的升高而下降的原因可能是________。
(4)利用反应6NO2+8NH3=7N2+12H2O设计成原电池,既能减轻氮氧化物对环境的污染,又能充分利用化学能,装置如图3所示。
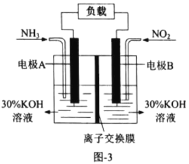
①电极B是________极(填“正”或者“负”)。
②A电极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe2+的核外电子排布式__。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有__和__。1molK4[Fe(CN)6]含有σ键为__mol。
(3)黄血盐中N原子的杂化方式为__;C、N、O的第一电离能由大到小的排序为__,电负性由大到小的排序为__。
(4)Fe、Na、K的晶体结构如图所示:
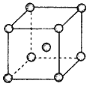
①钠的熔点比钾更高,原因是__。
②Fe原子半径是rcm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是__g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com