
【题目】已知某二元酸H2A在溶液中存在如下电离:H2A=H++HAˉ,HAˉ![]() H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
A.![]()
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ)
D.1L溶液中的H+数目为0.02NA
【答案】B
【解析】
A.![]() ,根据题意可知H2A第一步完全电离,第二步部分电离,所以0.01mol·L-1的H2A溶液中c(H+)>0.01mol/L,K=1.2×10-2,所以
,根据题意可知H2A第一步完全电离,第二步部分电离,所以0.01mol·L-1的H2A溶液中c(H+)>0.01mol/L,K=1.2×10-2,所以![]() <1.2,故A错误;
<1.2,故A错误;
B.H2A第一步完全电离,第二步部分电离,所以0.01mol·L-1的H2A溶液中c(H+)>0.01mol/L,则溶液的pH小于2,故B正确;
C.由于第一步完全电离,所以溶液中并不存在H2A,故C错误;
D.H2A第一步完全电离,第二步部分电离,所以0.01mol·L-1的H2A溶液中0.01mol/L<c(H+)<0.02mol/L,则1L该溶液中氢离子数目小于0.02NA,故D错误;
答案为B。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
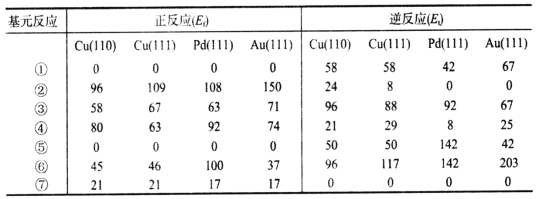
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
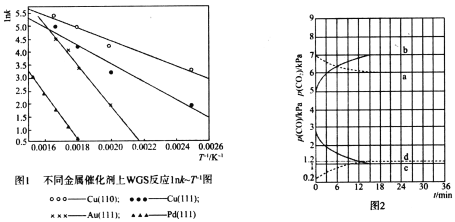
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
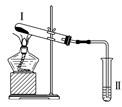
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为amol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则( )

A.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
B.x的取值范围是0<x<![]()
C.A点横坐标的值随x发生变化
D.x=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断下列有关说法正确的是( )
A.羰基硫属于非极性分子B.羰基硫的电子式为![]()
C.羰基硫的沸点比CO2低D.羰基硫分子中三个原子处于同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_________________,其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为_____________(用元素符号表示)。
②N、O两元素的的第一电离能由大到小的顺序为___________(用元素符号表示)。
③SO42-中S原子的杂化方式为___________,VSEPR模型名称为___________________。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+。该阴离子的电子式为_____,σ键和π键的数目之比为______________。其空间构型为__________。
(4)K3[Fe(CN)6]晶体中配离子的配位体为_____(用化学符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
![]()
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________________________。
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。

a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的________________________点。
b.当压强为10MPa、温度为T时的平衡常数Kp=________________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
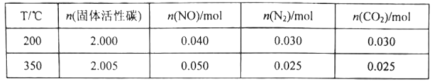
①该反应的正反应为________________________(填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为________________________。
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:
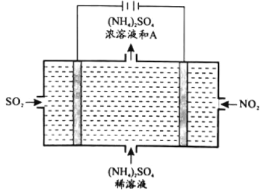
①阴极的电极反应式为________________________。
②上图中A物质是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁[Fe(C5H5)2];二茂铁分子是一种金属有机配合物,结构如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是( )
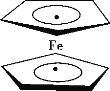
A.1mol环戊二烯(![]() )中含有5NA σ键
)中含有5NA σ键
B.二茂铁分子中存在配位键
C.环戊二烯分子中所有原子共平面
D.Fe2+的价电子排布式为3d44s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com