
【题目】火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断下列有关说法正确的是( )
A.羰基硫属于非极性分子B.羰基硫的电子式为![]()
C.羰基硫的沸点比CO2低D.羰基硫分子中三个原子处于同一直线上
【答案】D
【解析】
根据已知,羰基硫中分子中所有原子的最外层都满足8电子结构,C最外层4个电子,达到稳定结构,需要形成4对共用电子对,O和S最外层均为6个电子,达到稳定结构,需要形成4个共用电子对,因此COS中C原子分别和S和O形成2对共用电子对,电子式为![]() 。
。
A.COS中S和O对共用电子对的吸引能力不同,使得正负电荷中心不重合,因此COS是极性分子,A错误;
B.COS的电子式为![]() ,B错误;
,B错误;
C.COS和CO2均为共价分子,其沸点与分子间作用力有关;一般情况下,相对分子质量越大,分子间作用力越大,沸点越高,因此COS的沸点比CO2高,C错误;
D.中心C原子的价层电子数![]() ,C采取sp杂化,为直线型分子,D正确;
,C采取sp杂化,为直线型分子,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和粗铜的精炼原理。
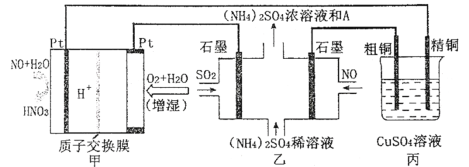
(1)燃料电池放电过程中负极的电极反应式____。
(2)乙装置中物质A是____(填化学式),理由是___;电解过程中阳极附近pH___(填“增大”“减小”或“不变”),阴极的电极反应式是____。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将__(填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质的量共有____mol;丙装置中阴极析出铜的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO![]() +NO
+NO![]() +_____=Mn2++NO
+_____=Mn2++NO![]() +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
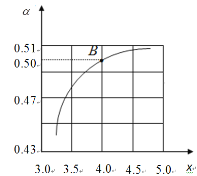
其它条件不变时,α随着x/span>增大而增大的原因是____;图中的B点处NH3的平衡转化率为____。
II.(4)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___(用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是
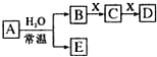
A.若X是Na2CO3,C为CO2,则A一定是氯气,此时D和E不反应
B.若X是CO2,B和D的反应是OH-+![]() =
=![]() +H2O,则E一定能还原Fe2O3
+H2O,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸钠![]() 可用于化学镀镍。将黄磷
可用于化学镀镍。将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() ,
,![]() 是一种无色、有毒的可燃性气体,与
是一种无色、有毒的可燃性气体,与![]() 溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
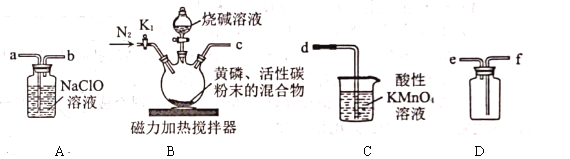
①装好药品,②连接装置,检查气密性,③打开![]() ,再通入一段时间
,再通入一段时间![]() ,④将反应所得的次磷酸钠分离出来,⑤关闭
,④将反应所得的次磷酸钠分离出来,⑤关闭![]() ,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开
,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开![]() 通入
通入![]() 一段时间。请回答下列问题:
一段时间。请回答下列问题:
(1)正确实验操作步骤的顺序是________(填序号)。
(2)实验装置中各导管口的连接顺序是________(填装置中的小写字母)。
(3)在黄磷中混入活性炭粉末的作用是________。
(4)先滴加烧碱溶液,再打开磁力加热搅拌器可能的原因是________。
(5)装置![]() 中反应的化学方程式是________。
中反应的化学方程式是________。
(6)![]() 和
和![]() 的溶解度
的溶解度![]() 如下:
如下:
|
| |
| 37 | 39 |
| 100 | 667 |
实验结束后,将A中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为________,然后________、冷却结晶、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(7)测定产品的纯度:取产品![]() 克配成
克配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,酸化后加入
于锥形瓶中,酸化后加入![]() 碘水于暗处充分反应得
碘水于暗处充分反应得![]() ,然后以淀粉溶液作指示剂,用
,然后以淀粉溶液作指示剂,用![]() 溶液滴定至终点,平均消耗
溶液滴定至终点,平均消耗![]() ,若其它杂质不参加反应,则产品纯度表达式为________。(已知:
,若其它杂质不参加反应,则产品纯度表达式为________。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2A在溶液中存在如下电离:H2A=H++HAˉ,HAˉ![]() H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
A.![]()
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ)
D.1L溶液中的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题给要求填空
(1)某元素的基态原子最外层电子排布式为3s23p2,它的次外层上电子云形状有________种,原子中所有电子占有________个轨道,核外共有________种运动状态不同的电子。
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是_______。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是______。
(4)M能层上有________个能级,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格列本脲是一种降糖及利尿的药物,一种合成格列本脲的路线如图:
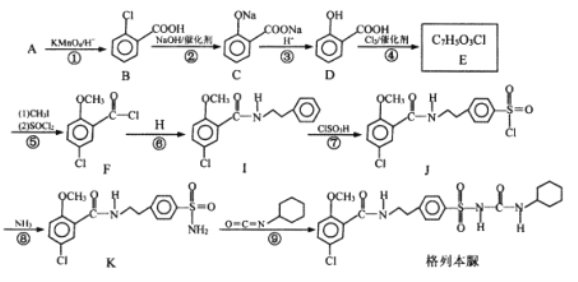
已知:(1)![]() (2)
(2)![]()
回答下列问题:
(1)B含有的官能团名称是_______,D的名称是__________。
(2)H的结构简式为__________。
(3)写出下列反应的反应类型:⑥__________,⑨__________。
(4)写出E与CH3I反应的化学反应方程式__________。
(5)符合下列要求的E的同分异构体有__________种。
①具有酯基、能发生银镜反应 ②遇FeCl3溶液显紫色
(6)以甲苯和![]() 为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(
为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(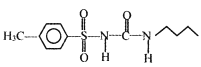 )的合成路线_____________.
)的合成路线_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com