
����Ŀ��ijѧ��������ͼʵ��װ��̽������ʽԭ��صĹ���ԭ��������Ҫ�����λش��������⣺

��1��д����������ԭ��Ӧ�����ӷ���ʽ��_______________
��2��װ���������г�������֬�⣬��Ҫ����KCl�ı�
����Һ����ع���ʱ���������е�K����Cl������
������ı�����ȷ����________��
A�������е�K��������ձ��ƶ���Cl�����Ҳ��ձ��ƶ�
B�������е�K�����Ҳ��ձ��ƶ���Cl��������ձ��ƶ�
C�������е�K����Cl����������ձ��ƶ�
D�������е�K����Cl�����������ƶ�
��3����֪��ԭ���װ���ڷ�Ӧǰ���缫������ȣ�һ��ʱ��������������12.9 g
������ͨ���ĵ�����ĿΪ________ (�á�NA����ʾ)��
��4�������Ի�ѧ��Ӧ��2Zn��O2��4H��=2Zn2����2H2OΪ�������һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H����Zn2�����й�������ԭ��صĸ���������________�����������ĵ缫��ӦΪ��__________________��
��5����CH4��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���£�����d�缫��________�����������������C�缫�ķ�Ӧ����ʽΪ��_____________

������·��ת��4 mol���ӣ�������ȼ�ϵ�����ĵ�O2�ڱ�״���µ����Ϊ____L��
�۵�ع���һ��ʱ�����Һ������_________�����ǿ�������������䡱��
���𰸡� Zn + Cu2+ = Zn2+ + Cu B 0.2 NA п��Zn O2+4e- +4H��=2H2O ���� CH4��8e����2H2O===CO2��8H�� 22.4 ����
����������1��ԭ����з������Է���������ԭ��Ӧ��Zn������ͭ��Һ�ķ�Ӧ�������ӷ���ʽΪZn + Cu2+ = Zn2+ + Cu��
��2������ձ���пʧ���ӱ��п���ӣ�ʹ��п�缫����������ɣ�����������������ձ��ƶ����Ҳ��ձ���ͭ���ӵõ����ӱ��ͭ��ʹ��ͭ�缫����������ɣ��������������Ҳ��ձ��ƶ����������е�K+���Ҳ��ձ��ƶ���Cl-������ձ��ƶ���
�ʴ�ΪB��
��3��ZnΪ���������ĵ缫��ӦΪZn-2e-=Zn2+��CuΪ���������ĵ缫��ӦΪCu2++2e- = Cu����ת�Ƶ��ӵ����ʵ���Ϊnmol��һ��ʱ��������������12.9 gʱ��64g/mol��![]() +65g/mol��
+65g/mol��![]() =12.9g�����n=0.2mol��������ͨ���ĵ�����ĿΪ0.2 NA ��
=12.9g�����n=0.2mol��������ͨ���ĵ�����ĿΪ0.2 NA ��
(4) �ɷ�Ӧ2Zn+O2+4H+�T2Zn2++2H2O��֪��Zn����������Zn2+��Ϊ������Ӧ������������������ԭ��Ӧ���缫����ʽΪO2+4e- +4H��=2H2O��
��5������c�ǵ���������һ������cΪ������dΪ������������л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2���缫��ӦʽΪ��CH4-8e-+2H2O�TCO2+8H+��
��ԭ����������缫��ӦΪ2O2+8H++8e-�T4H2O����ת��4mol����ʱ���������������ʵ���Ϊ1.0mol�����Ϊ1.0mol��22.4L/mol=22.4L��
��ԭ��ع������ܵ缫��ӦʽΪ2O2+CH4�TCO2+2H2O����Һ��H+���ʵ������䣬����Һ��ˮ�������࣬���ع���һ��ʱ�����Һ�����Լ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ����( )
A. ����FeI2����Һ��ͨ����������������1molFe2+������ʱ���÷�Ӧת�Ƶ�����ĿΪ3NA
B. 40gCuO��Cu2S�����������ͭԭ�ӵ���Ŀ������0.5 NA
C. ��0.1molNH4HSO4����Һ�У���������Ŀ��С��0.2NA
D. C3H8�����е�2��Hԭ�ӷֱ�1����NH2��1����OHȡ����1mol���л����������õ��Ӷ���ĿΪ13NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ������˵����ȷ����( )
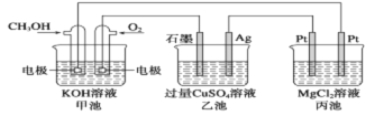
A���׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҡ������ǻ�ѧ��ת�����ܵ�װ��
B���׳�ͨ��CH3OH�ĵ缫��ӦʽΪCH3OH��6e����2H2O===CO32-��8H��
C����Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2������ʹCuSO4��Һ�ָ���ԭŨ��
D���׳�������280 mL(��״����)O2����ʱ������������������14. 5 g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪W��X��Y��Z�Ƕ�����Ԫ�أ�aW3+��bX+��cY2����dZ���������Ӿ�����ͬ�ĵ��Ӳ�ṹ�����й�ϵ��ȷ���ǣ� ��
A.������������Y��Z
B.�˵������a��b
C.�ȶ��ԣ�H2Y��HZ
D.X����һ���ܴ�W������Һ���û���W����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������� ��2һ������ ������ ��2һ������ ��2��2��������������ʵķе�����˳����ȷ���� ( )
A. ��>��>��>��>�� B. ��>��>��>��>��
C. ��>��>��>��>�� D. ��>��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ʵ������Ա仯�������� ��
A.ԭ�Ӱ뾶
B.Ԫ�ص���Ҫ���ϼ�
C.���ԭ������
D.�����Ժͷǽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե�ʯ��[��Ҫ�ɷ�ΪCa(OH)2��CaCO3]Ϊԭ���Ʊ�KClO3������������
![]()

��1���Ȼ����̿��Ƶ�ʯ����������75�����ҽ��С��Ȼ�ʱ����Cl2��Ca(OH)2��������Ca(ClO)2�ķ�Ӧ��Ca(ClO)2��һ��ת��ΪCa(ClO3)2������Ca(ClO)2 �ֽ�ΪCaCl2��O2��
������Ca(ClO)2�Ļ�ѧ����ʽΪ ��
�����Cl2ת��ΪCa(ClO3)2��ת���ʵĿ��д�ʩ�� ������ţ���
A���ʵ�����ͨ��Cl2���� B����ֽ��转�� C����ˮʹCa(OH)2��ȫ�ܽ�
��2���Ȼ�������Cl2 ת��ΪCa(ClO3)2���ܷ�Ӧ����ʽΪ
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O�� �Ȼ���ɺ���ˡ�
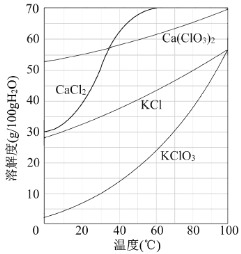
����������Ҫ�ɷ�Ϊ ���ѧʽ����
����Һ��Ca(ClO3)2��CaCl2�����ʵ���֮��n[Ca(ClO3)2] ��n[CaCl2] 1��5�����������������=������
��3������Һ�м����Թ���KCl����ɽ�Ca(ClO3)2ת��ΪKClO3������Һ��KClO3�ĺ���Ϊ100gL-1���Ӹ���Һ�о����ܶ������KClO3����ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м��ܸ�����������Һ��Ӧ�����ܸ�ϡHCl��Ӧ���ǣ� �� ��Al2O3 ��Al��OH��3 �ۣ�NH4��2CO3 ��NaHCO3 ��BaCl2 ��
A.�ۢܢ�
B.�ڢۢܢ�
C.�٢ڢۢ�
D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ���������Һ�����ַ�ɢϵ�ı���������
A. �Ƿ��ж�������� B. �Ƿ���ͨ����ֽ
C. ��ɢ�����ӵĴ�С��ͬ D. �Ƿ��һ�������ȶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com