
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O, 氯化完成后过滤。
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
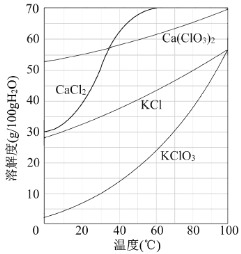
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
【答案】(1)①2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ②AB (2)①CaCO3、Ca(OH)2 ②< (3)蒸发浓缩、冷却结晶
【解析】(1)①氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,则生成Ca(ClO)2的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O。
②A.适当减缓通入Cl2速率可以使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,A正确;B.充分搅拌浆料可以增大反应物的接触面积,使氯气被氢氧化钙充分吸收而反应,可以提高氯气的转化率,B正确;C.加水使Ca(OH)2完全溶解氢氧化钙浓度降低,不利于氯气的吸收,C错误,答案选AB。
(2)①碳酸钙不溶于水,与氯气不反应,氢氧化钙微溶,因此滤渣的主要成分为CaCO3、Ca(OH)2。
②由于氯气还能与氢氧化钙反应生成次氯酸钙、氯化钙和水,因此滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2]<1∶5。
(3)根据图像可知氯酸钾的溶解度受温度影响最大,因此从该溶液中尽可能多地析出KClO3固体的方法是蒸发浓缩、冷却结晶。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】将Al片和Cu片用导线联接,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分别形成的原电池,在这两个原电池中,负极分别为( )
A.Cu片、Al片
B.Al片、Cu片
C.Al片、Al片
D.Cu片、Cu片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
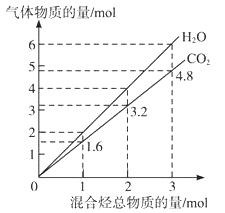
①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ②⑤⑥ B. ②⑥ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下图实验装置探究盐桥式原电池的工作原理,按照要求依次回答下列问题:

(1)写出该氧化还原反应的离子方程式:_______________
(2)装置中盐桥中除添加琼脂外,还要添加KCl的饱
和溶液,电池工作时,对盐桥中的K+、Cl-的移
动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)已知该原电池装置在反应前两电极质量相等,一段时间后两极质量相差12.9 g
则导线中通过的电子数目为________ (用“NA”表示);
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则原电池的负极材料是________,正极发生的电极反应为:__________________。
(5)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:①则d电极是________(填“正极”或“负极”)C电极的反应方程式为:_____________

②若电路中转移4 mol电子,则上述燃料电池消耗的O2在标准状况下的体积为____L。
③电池工作一段时间后溶液的酸性_________(填“增强”“减弱”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 B. Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 C. 乙醇和乙酸都能溶于水,都是电解质 D. 分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于中和热测定实验,下列说法不正确的是
A.烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失
B.使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计
C.向盛装酸溶液的烧杯中加碱溶液时要小心缓慢
D.测过酸的温度计要用水清洗后再测碱的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:

请回答下列问题:
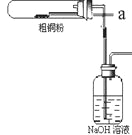
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略)。观察到的现象是______________,
写出铜与氯气反应的化学方程式 ______________________。
(2)上述流程中固体K溶于稀盐酸的目的是___________________。试剂X、固体J的物质分别为____________________。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式____________________。
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是_____________。该腐蚀过程的正极反应式为___________________。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com