
【题目】下列说法正确的是
A. 向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 B. Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 C. 乙醇和乙酸都能溶于水,都是电解质 D. 分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
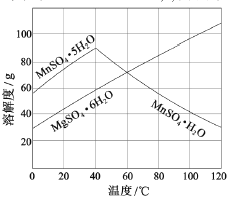
(3)右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需
控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应无论怎样调整反应物的用量都只能生成一种物质的是
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.1,3—丁二烯与氢气发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①丁烷 ②2一甲基丙烷 ③戊烷 ④2一甲基丁烷 ⑤2,2—二甲基丙烷等物质的沸点排列顺序正确的是 ( )
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
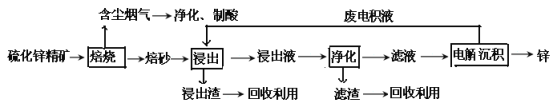
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体_。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O, 氯化完成后过滤。
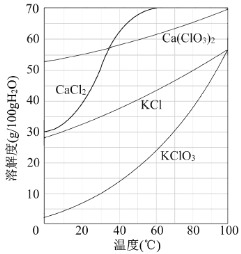
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等
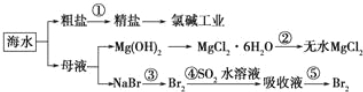
A.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl26H2O灼烧即可制得无水MgCl2
C.从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V、W、X、Y、Z是五种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:

已知Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成盐;Z是地壳中含量最多的元素;W原子的最外层电子数与Ne原子的最外层电子数相差1;V为原子核内有12个中子的二价金属,当2 .4克V与足量盐酸反应时,在标准状况下放出气体2.24L;请回答下列问题:
(1)指出Y元素在周期表中的位置_________。
(2)写出W的简单离子的结构示意图_______________。
(3)比较W的气态氢化物与H2S和HF的稳定性(由强到弱)____________。(填化学式)
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,写出该化合物的电子式____________。
(5)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,则该物质含有的化学键类型为_____________。
(6)V与W两元素最高价氧化物的水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题
(1)实验室制取纯净氯气的实验中,除了二氧化锰、浓盐酸和浓硫酸,还需要___________、________(填写试剂或溶液名称)
(2)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:____________________
(3)图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是 (填“a”“b”或“c”)。
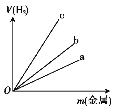
(4)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,该氢化物与足量盐酸反应的化学反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com