
【题目】关于中和热测定实验,下列说法不正确的是
A.烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失
B.使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计
C.向盛装酸溶液的烧杯中加碱溶液时要小心缓慢
D.测过酸的温度计要用水清洗后再测碱的温度
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物在材料领域一直扮演重要角色。下列叙述中,不正确的是( )
A. 石英可用来制作工艺品 B. 硅单质可以用来制造太阳能电池
C. 硅单质是制造玻璃的主要原料 D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z是短周期元素,aW3+、bX+、cY2﹣、dZ﹣四种离子具有相同的电子层结构,下列关系正确的是( )
A.最外层电子数:Y>Z
B.核电荷数:a>b
C.稳定性:H2Y>HZ
D.X单质一定能从W的盐溶液中置换出W单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O, 氯化完成后过滤。
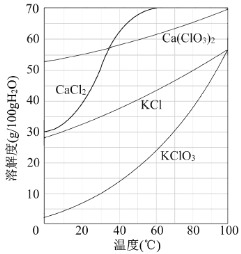
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
![]()
(1)能与X发生化学反应的酸是________,由X制备Mg2Z的化学方程式为:____________。
(2)由Mg2Z生成Y的化学反应方程式为_______________,Y分子的电子式为__________。
(3)Z、X中共价键的类型分别是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟氢氧化钠溶液反应,又能跟稀HCl反应的是( ) ①Al2O3 ②Al(OH)3 ③(NH4)2CO3 ④NaHCO3 ⑤BaCl2 .
A.③④⑤
B.②③④⑤
C.①②③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( 14分)
I .(1)已知H2的燃烧热285.8KJ/mol,写出液态水电解生成H2和O2的热化学方程式 ;
(2)已知2SO2(g)+O2(g) = 2SO3(g) ΔH=-197 kJ/mol,相同温度和压强条件下,4molSO2和2molO2充入容器中反应至平衡时放出的能量为Q KJ,则Q 394KJ(填“>”“<”或“=”)
II.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)由表中数据判断ΔH2 0(填“>”、“<”或“=”),
(2)若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.恒温恒容充入He,使体系总压强增大
E.按原比例再充入 CO和 H2
(3)某温度下,将2 mol CO和6 mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(4)恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com