
ЎҫМвДҝЎҝ( 14·Ц)
I .ЈЁ1Ј©ТСЦӘH2өДИјЙХИИ285.8KJ/molЈ¬РҙіцТәМ¬Л®өзҪвЙъіЙH2әНO2өДИИ»ҜС§·ҪіМКҪ Ј»
ЈЁ2Ј©ТСЦӘ2SO2(g)+O2(g) = 2SO3(g) ҰӨHЈҪЈӯ197 kJ/molЈ¬ПаН¬ОВ¶ИәНС№ЗҝМхјюПВЈ¬4molSO2әН2molO2ідИлИЭЖчЦР·ҙУҰЦБЖҪәвКұ·ЕіцөДДЬБҝОӘQ KJЈ¬ФтQ 394KJ(МоЎ°>ЎұЎ°<Ўұ»тЎ°=Ўұ)
II.јЧҙјКЗТ»ЦЦҝЙФЩЙъДЬФҙЈ¬ҫЯУР№г·әөДҝӘ·ўәНУҰУГЗ°ҫ°ЎЈ№ӨТөЙПТ»°гІЙУГПВБРБҪЦЦ·ҙУҰәПіЙјЧҙјЈә
·ҙУҰIЈәCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ҰӨH1
CH3OH(g)+H2O(g) ҰӨH1
·ҙУҰIIЈәCO(g)+2H2(g)![]() CH3OH(g) ҰӨH2
CH3OH(g) ҰӨH2
ПВұнЛщБРКэҫЭКЗ·ҙУҰўтФЪІ»Н¬ОВ¶ИПВөД»ҜС§ЖҪәвіЈКэ(K)
ОВ¶И | 250Ўж | 300Ўж | 350Ўж |
K | 2.041 | 0.270 | 0.012 |
ЈЁ1Ј©УЙұнЦРКэҫЭЕР¶ПҰӨH2 0(МоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°ЈҪЎұ)Ј¬
ЈЁ2Ј©ИфИЭЖчИЭ»эІ»ұдЈ¬ПВБРҙлК©ҝЙФцјУјЧҙјІъВКөДКЗ Ј¬
AЈ®ЙэёЯОВ¶И
BЈ®Ҫ«CH3OH(g)ҙУМеПөЦР·ЦАл
CЈ®К№УГәПККөДҙЯ»ҜјБ
DЈ®әгОВәгИЭідИлHeЈ¬К№МеПөЧЬС№ЗҝФцҙу
EЈ®°ҙФӯұИАэФЩідИл COәН H2
ЈЁ3Ј©ДіОВ¶ИПВЈ¬Ҫ«2 mol COәН6 mol H2ідИл2LөДәгИЭГЬұХИЭЖчЦРЈ¬ід·Ц·ҙУҰЈ¬ҙпөҪЖҪәвәуЈ¬ІвөГc(CO)=0.2 molЎӨL-1Ј¬ФтCOөДЧӘ»ҜВКОӘ Ј¬ҙЛКұөДОВ¶ИОӘ (ҙУЙПұнЦРСЎФс)Ј»
ЈЁ4Ј©әгОВПВЈ¬1mol COәНnmol H2ФЪТ»ёцИЭ»эҝЙұдөДГЬұХИЭЖчЦР·ҙУҰҙпөҪЖҪәвәуЈ¬ЙъіЙa molCH3OHЈ®ИфЖрКјКұ·ЕИл3molCO+3nmolH2Ј¬ФтҙпЖҪәвКұЙъіЙCH3OH_______molЎЈ
Ўҫҙр°ёЎҝ
IЈ®ЈЁ1Ј©H2O(l)=H2(g)+O2(g)ҰӨH=+285.8KJ/molЈЁ2Ј©<
II.ЈЁ1Ј©ЈјЈЁ2Ј©BEЈЁ3Ј©80%Ј»250ЎжЈЁ4Ј©3a
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәIЈ®ЈЁ1Ј©ТСЦӘH2өДИјЙХИИ285.8KJ/molЈ¬ЖдИјЙХөДИИ»ҜС§·ҪіМКҪОӘ H2(g) + ![]() O2(g) = H2O(l) ЎчH=-285.8 kJ/molЈ»ФтТәМ¬Л®өзҪвЙъіЙЗвЖшәНСхЖшөДИИ»ҜС§·ҪіМКҪОӘH2O(l) = H2(g)+
O2(g) = H2O(l) ЎчH=-285.8 kJ/molЈ»ФтТәМ¬Л®өзҪвЙъіЙЗвЖшәНСхЖшөДИИ»ҜС§·ҪіМКҪОӘH2O(l) = H2(g)+ ![]() O2(g) ҰӨH=+285.8KJ/molЈ»
O2(g) ҰӨH=+285.8KJ/molЈ»
ЈЁ2Ј©SO2әНO2·ҙУҰЙъіЙSO3КЗҝЙДж·ҙУҰЈ¬ЧӘ»ҜВКІ»ҝЙДЬҙпөҪ100%Ј¬4molSO2әН2molO2ідИлИЭЖчЦР·ҙУҰЦБЖҪәвКұЈ¬КөјКІОјУ·ҙУҰөДSO2өДОпЦКөДБҝРЎУЪ4molЈ¬Фт·ЕіцөДДЬБҝОӘQ <394KJЈ»
IIЈ®ЈЁ1Ј©ёщҫЭНјұнЦӘЈ¬·ҙУҰўтЛжОВ¶ИЙэёЯЈ¬ЖҪәвіЈКэјхРЎЈ¬ЛөГчЙэёЯОВ¶ИЖҪәвДжПтТЖ¶ҜЈ¬ЛщТФёГ·ҙУҰКЗ·ЕИИ·ҙУҰЈ¬ФтЎчH2Јј0Ј»
ЈЁ2Ј©AЈ®ЙэёЯОВ¶ИЈ¬ЖҪәвДжТЖЈ¬јЧҙјІъВКҪөөНЈ¬№КҙнОуЈ»BЈ®Ҫ«CH3OH(g)ҙУМеПөЦР·ЦАліцАҙЈ¬ЖҪәвХэТЖЈ¬јЧҙјІъВКФцҙ󣬹КХэИ·Ј»CЈ®К№УГәПККөДҙЯ»ҜјБЈ¬ЖҪәвІ»ТЖ¶ҜЈ¬№КҙнОуЈ»DЈ®ідИлHeЈ¬К№МеПөЧЬС№ЗҝФцҙуЈ¬ЖҪәвІ»ТЖ¶ҜЈ¬№КҙнОуЈ»EЈ®°ҙФӯұИАэФЩідИлCOәНH2Ј¬ФцҙуБЛС№ЗҝЖҪәвХэТЖЈ¬јЧҙјІъВКФцҙ󣬹КХэИ·Ј»№Кҙр°ёОӘBEЈ»
ЈЁ3Ј©°ҙ·ҙУҰIIід·Ц·ҙУҰҙпөҪЖҪәвәуЈ¬ІвөГc(CO)=0.2mol/LЈ¬ОпЦКөДБҝОӘ0.4molЈ»
CO (g)+2H2 (g)![]() CH3OH (g)
CH3OH (g)
ЖрКјБҝ(mol) 2 6 0
ұд»ҜБҝ(mol) x 2x x
ЖҪәвБҝ(mol) 2-x 6-2x x
ЖҪәвКұТ»Сх»ҜМјөДОпЦКөДБҝЈә2-x=0.4molЈ¬ЛщТФx=1.6mol
ЖҪәвКұёчОпЦКөДЕЁ¶ИЈәc(CO)=0.2mol/LЎБ2L=0.4molЈ¬c(H2)=![]() =1.4mol/LЈ¬c(CH3OH)=1.6/2=0.8mol/LЈ»
=1.4mol/LЈ¬c(CH3OH)=1.6/2=0.8mol/LЈ»
Т»Сх»ҜМјөДЧӘ»ҜВК=![]() =80%Ј¬K=
=80%Ј¬K=![]() =2.041Ј¬УЙұнёсҝЙЦӘОВ¶ИОӘ250ЎжЈ»
=2.041Ј¬УЙұнёсҝЙЦӘОВ¶ИОӘ250ЎжЈ»
ЈЁ4Ј©әгОВПВЈ¬1mol COәНnmol H2ФЪТ»ёцИЭ»эҝЙұдөДГЬұХИЭЖчЦР·ҙУҰҙпөҪЖҪәвәуЈ¬ЙъіЙa molCH3OHЈ®ИфЖрКјКұ·ЕИл3molCO+3nmolH2Ј¬ТАҫЭәгОВәгС№ИЭЖчЦРҙпөҪөДЖҪәвКЗөИР§ЖҪәвЈ¬ЛщТФИЭЖчЦРЙъіЙјЧҙјОпЦКөДБҝОӘ3aЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ШУЪЦРәНИИІв¶ЁКөСйЈ¬ПВБРЛө·ЁІ»ХэИ·өДКЗ
AЈ®ЙХұӯјдМоВъЛйЕЭДӯЛЬБПКЗОӘБЛјхЙЩКөСй№эіМЦРөДИИБҝЛрК§
BЈ®К№УГ»·РОІЈБ§ҪБ°и°фјИҝЙТФҪБ°иУЦҝЙТФұЬГвЛр»өОВ¶ИјЖ
CЈ®ПтКўЧ°ЛбИЬТәөДЙХұӯЦРјУјоИЬТәКұТӘРЎРД»әВэ
DЈ®Ів№эЛбөДОВ¶ИјЖТӘУГЛ®ЗеПҙәуФЩІвјоөДОВ¶И
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРТФПВОеЦЦОпЦКЈәA.![]() ЎЎBЈ®Ca(ClO)2ЎЎCЈ®NO2ЎЎDЈ®SiO2ЎЎEЈ®өн·ЫЈ¬ЗлёщҫЭМвТвЈ¬СЎФсЗЎөұөДСЎПоУГЧЦДёҙъәЕМоҝХЎЈ
ЎЎBЈ®Ca(ClO)2ЎЎCЈ®NO2ЎЎDЈ®SiO2ЎЎEЈ®өн·ЫЈ¬ЗлёщҫЭМвТвЈ¬СЎФсЗЎөұөДСЎПоУГЧЦДёҙъәЕМоҝХЎЈ
(1)ЖҜ°Ч·ЫөДУРР§іЙ·ЦКЗ__________Ј»ЎЎЎЎЎЎЎЎ
(2)НЁіЈЧҙҝцПВіКәмЧШЙ«өДКЗ__________Ј»
(3)№вПЛЦЖЖ·өД»щұҫФӯБПКЗ__________Ј»
(4)НЁіЈЧҙҝцПВҙшУРМШКвЖшО¶ЎўІ»ИЬУЪЛ®өДТәМеКЗ__________Ј»
(5)ФЪіЈОВПВЈ¬УцөвұдА¶өДКЗ________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝәПҪрЦьЗвІДБПҫЯУРУЕТмөДОь·ЕЗвРФДЬЈ¬ФЪЕдәПЗвДЬөДҝӘ·ўЦРЖрөҪЦШТӘЧчУГЎЈ
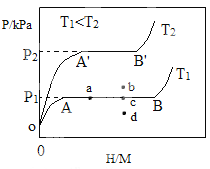
ЈЁ1Ј©Т»¶ЁОВ¶ИПВЈ¬ДіЦьЗвәПҪр(M)өДЦьЗв№эіМИзНјЛщКҫЈ¬ЧЭЦбОӘЖҪәвКұЗвЖшөДС№ЗҝЈЁpЈ©Ј¬әбЦбұнКҫ№МПаЦРЗвФӯЧУУлҪрКфФӯЧУөДёцКэұИЈЁH/MЈ©ЎЈФЪOA¶ОЈ¬ЗвИЬҪвУЪMЦРРОіЙ№МИЬМеMHxЈ¬ЛжЧЕЗвЖшС№ЗҝөДФцҙуЈ¬H/MЦрІСФцҙуЈ»ФЪAB¶ОЈ¬MHУлЗвЖш·ўЙъЗв»Ҝ·ҙУҰЙъіЙЗв»ҜОпMHyЈ¬Зв»Ҝ·ҙУҰ·ҪіМКҪОӘЈәzMHx(s)+H2(g)![]() zMHy(s) ЎчH1(I)Ј»BөгЈ¬Зв»Ҝ·ҙУҰҪбКшЈ¬ҪшТ»ІҪФцҙуЗвЖшС№ЗҝЈ¬H/MјёәхІ»ұдЎЈ
zMHy(s) ЎчH1(I)Ј»BөгЈ¬Зв»Ҝ·ҙУҰҪбКшЈ¬ҪшТ»ІҪФцҙуЗвЖшС№ЗҝЈ¬H/MјёәхІ»ұдЎЈ
·ҙУҰ(I)өДмКұдЎчHўс_______0ЈЁМоЎ°>ЎұЎ°<Ўұ»тЎ°=ЎұЈ©ЎЈ
·ҙУҰ(I)ЦРz=___________ЈЁУГә¬xәНyөДҙъКэКҪұнКҫЈ©ЎЈ
ОВ¶ИОӘT1КұЈ¬2gДіәПҪр4minДЪОьКХЗвЖш240mLЈ¬ОьЗвЛЩВКv=________mLg1min1ЎЈ
ЈЁ2Ј©өұ·ҙУҰ(I)ҙҰУЪНјЦРaөгКұЈ¬ұЈіЦОВ¶ИІ»ұдЈ¬ПтәгИЭМеПөЦРНЁИлЙЩБҝЗвЖшЈ¬ҙпөҪЖҪәвәу·ҙУҰ(I)ҝЙДЬҙҰУЪНјЦРөД_______өгЈЁМоЎ°bЎұЎ°cЎұ»тЎ°dЎұЈ©Ј¬ёГЦьЗвәПҪрҝЙНЁ№э______»т_______өД·ҪКҪКН·ЕЗвЖшЎЈҰЗұнКҫөҘО»ЦКБҝЦьЗвәПҪрФЪЗв»Ҝ·ҙУҰҪЧ¶ОөДЧоҙуОьЗвБҝХјЖдЧЬОьЗвБҝөДұИАэЈ¬ФтОВ¶ИОӘT1ЎўT2КұЈ¬ҰЗ(T1)___ _______ҰЗ(T2)ЈЁМоЎ°>ЎұЎ°<Ўұ»тЎ°=ЎұЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЛДВИ»ҜМј°ҙ№ЩДЬНЕ·ЦАаУҰёГКфУЪЈЁ Ј©
A.НйМю
B.П©Мю
C.ВұҙъМю
D.фИЛб
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝWЎўXЎўYЎўZКЗЛДЦЦіЈјыөД¶МЦЬЖЪФӘЛШЈ¬ЖдФӯЧУ°лҫ¶ЛжФӯЧУРтКэұд»ҜИзНјЛщКҫЎЈТСЦӘWөДТ»ЦЦәЛЛШөДЦКБҝКэОӘ18Ј¬ЦРЧУКэОӘ10Ј»XәНNeФӯЧУөДәЛНвөзЧУКэПаІо1Ј»YөДөҘЦККЗТ»ЦЦіЈјыөД°лөјМеІДБПЈ»ZөД·ЗҪрКфРФФЪН¬ЦЬЖЪЦчЧеФӘЛШЦРЧоҙуЎЈ
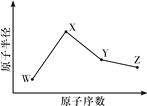
(1)XО»УЪФӘЛШЦЬЖЪұнЦРөДО»ЦГКЗ____________________ЎЈ
(2)ZөДЖшМ¬Зв»ҜОпәНде»ҜЗвПаұИЈ¬ҪПОИ¶ЁөДКЗ____________(Рҙ»ҜС§КҪ)ЎЈ
(3)WУлXРОіЙөДТ»ЦЦ»ҜәПОпәНЛ®·ҙУҰДЬЙъіЙWөДөҘЦКЈ¬ЗлРҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪЈә________________________________________________________________________ЎЈ
(4)YУлZРОіЙөД»ҜәПОпәНЧгБҝЛ®·ҙУҰЈ¬ЙъіЙТ»ЦЦИхЛбәНТ»ЦЦЗҝЛбЈ¬ёГ·ҙУҰөД»ҜС§·ҪіМКҪКЗ________________________________________________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝМЗАаЎўЦ¬·ҫәНө°°ЧЦККЗО¬іЦИЛМеЙъГь»о¶ҜЛщұШРиөДИэҙуУӘСшОпЦКЎЈТФПВРрКцХэИ·өДКЗ
AЈ®ЦІОпУНІ»ДЬК№деөДЛДВИ»ҜМјИЬТәНКЙ«
BЈ®ЖПМСМЗДЬ·ўЙъСх»Ҝ·ҙУҰәНЛ®Ҫв·ҙУҰ
C.ВуСҝМЗЛ®ҪвөДЧоЦХІъОпКЗЖПМСМЗ
DЈ®ө°°ЧЦКИЬТәУцБтЛбНӯәуІъЙъөДіБөнДЬЦШРВИЬУЪЛ®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйКТАпУГ¶юСх»ҜГМәНЕЁСОЛбјУИИЦЖИЎВИЖшЈ»
ЈЁ1Ј©ёГ·ҙУҰөДАлЧУ·ҪіМКҪОӘ____________________________ЎЈ
ёщҫЭ·ҙУҰФӯАнЈ¬НјТТЦРәПККөДЖшМе·ўЙъЧ°ЦГОӘ ______ ЎЈ
ЈЁ2Ј©ТІҝЙТФАыУГ·ҙУҰ2KMnO4+16HClЈЁЕЁЈ©ЁT2KCl+2MnCl2+5Cl2Ўь+8H2OЦЖИЎІўКХјҜҙҝҫ»ЎўёЙФпөДВИЖшЈ¬Іҝ·ЦЧ°ЦГИзНјјЧЛщКҫЎЈ
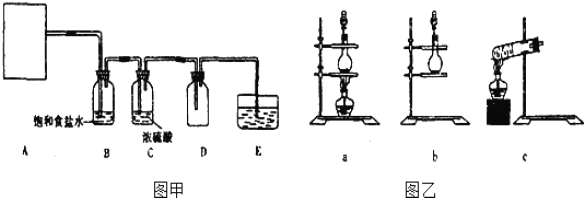
ёщҫЭ·ҙУҰФӯАнЈ¬НјТТЦРәПККөДЦЖЖшЧ°ЦГОӘ ______ ЎЈ
ЈЁ3Ј©Ч°ЦГBөДЧчУГКЗ ______ ЎЈ
ЈЁ4Ј©Ч°ЦГEөДЧчУГКЗ ______Ј¬EЦРөДКФјБҝЙСЎ ______ ЎЈ
AЈ®NaOHИЬТә BЈ®NaClИЬТә CЈ®іОЗеКҜ»ТЛ® DЈ®Л®
ЈЁ5Ј©ДіН¬С§НЁ№эПВБРБҪЦЦ·ҪКҪЦЖИЎВИЖшЈә
ўЩУГ8.7g MnO2УлЧгБҝЕЁСОЛб·ҙУҰЈ»
ўЪУГә¬14.6g HClөДЕЁСОЛбУлЧгБҝMnO2·ҙУҰХвБҪЦЦ·ҪКҪІъЙъCl2өДБҝөД№ШПөКЗ ______ЎЈ
AЈ®ўЩ¶а BЈ®ўЪ¶а CЈ®Т»Сщ¶а DЈ®І»И·¶ЁЈ®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ1 mol XДЬУлЧгБҝМјЛбЗвДЖИЬТә·ҙУҰ·Еіц44.8 L CO2(ұкЧјЧҙҝц)Ј¬ФтXөД·ЦЧУКҪКЗ
A. C5H10O4 B. C4H8O4 C. C3H6O4 D. C2H2O4
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com