
【题目】合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用。
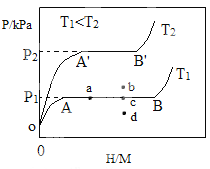
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)![]() zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
反应(I)的焓变△HⅠ_______0(填“>”“<”或“=”)。
反应(I)中z=___________(用含x和y的代数式表示)。
温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=________mLg1min1。
(2)当反应(I)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的_______点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)___ _______η(T2)(填“>”“<”或“=”)。
【答案】(10分)
(1)<(1分); 2/(y—x) (2分);30(2分)
(2)c(2分);加热(1分) 减压(1分);>(1分)
【解析】
试题分析:
(1) 氢化反应方程式为zMHx(s)+H2(g)![]() zMHy(s),根据氢原子守恒可得zx+2=zy,解得z=2/(y—x);吸氢速率v=240mL÷2g÷4min=30 mLg-1min-1;因为T1<T2,T2时氢气的压强大,说明升温向生成氢气的方向移动,逆反应为吸热反应,所以正反应为放热反应,则△H(Ⅰ)< 0。
zMHy(s),根据氢原子守恒可得zx+2=zy,解得z=2/(y—x);吸氢速率v=240mL÷2g÷4min=30 mLg-1min-1;因为T1<T2,T2时氢气的压强大,说明升温向生成氢气的方向移动,逆反应为吸热反应,所以正反应为放热反应,则△H(Ⅰ)< 0。
(2)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,氢气压强的增大,H/M逐惭增大,即a在AB段,加入的少量氢气反应生成固体,压强不变,所以恒容体系中加入少量氢气后应为c点;根据平衡移动原理,可以通过加热,使温度升高或减小压强使平衡向左移动,释放氢气;根据图像可知,横坐标相同,即氢原子与金属原子的个数比相同时,T2时氢气的压强大,说明T2时吸氢量少,则η(T1)>η(T2)。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列属于油脂的用途的是( )
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制取高级脂肪酸 ⑤制取汽油
A. ①②③ B. ①③⑤ C. ②③④⑤ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】( 14分)
I .(1)已知H2的燃烧热285.8KJ/mol,写出液态水电解生成H2和O2的热化学方程式 ;
(2)已知2SO2(g)+O2(g) = 2SO3(g) ΔH=-197 kJ/mol,相同温度和压强条件下,4molSO2和2molO2充入容器中反应至平衡时放出的能量为Q KJ,则Q 394KJ(填“>”“<”或“=”)
II.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)由表中数据判断ΔH2 0(填“>”、“<”或“=”),
(2)若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.恒温恒容充入He,使体系总压强增大
E.按原比例再充入 CO和 H2
(3)某温度下,将2 mol CO和6 mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(4)恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com