
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=—lgc(OH),下列正确的是
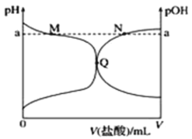
A.M 点所示溶液中可能存在:c(Cl)>c(NH4+)
B.M 点到Q点所示溶液中水的电离程度先变大后减小
C.Q 点盐酸与氨水恰好中和
D.N 点所示溶液中可能存在:c(NH4+)+c(NH3·H2O)=c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关X、Y、Z、R、W五种元素的叙述中,错误的是
X | ||||
Y | Z | |||
R | W |
A.常压下五种元素的单质中,Y的沸点最高
B.元素电负性:X>Z>Y
C.基态原子中未成对电子数最多的是R
D.元素最高价氧化物对应的水化物酸性:W>Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水是生活中常见污染物之一,可用电解法加以去除。实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl混合溶液来模拟该过程。
(1)电解处理氨氮废水电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
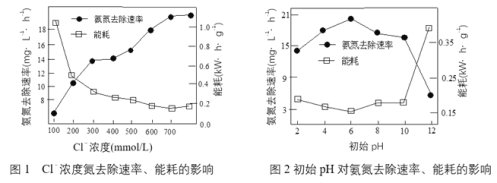
①根据图中数据,处理废水合适的条件是_______________。
②实验中发现阳极会持续产生细小气泡,气泡上浮过程中又迅速消失。结合图1,用电极反应式和离子方程式解释Cl-去除氨氮的原因_______________。
③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是_______________。
(2)氨的定量测定使用下图装置检测废水中的氨氮总量是否合格。
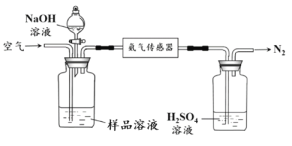
①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则样品混合液中氨氮(以氨气计)含量为_______________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.O3与SO2的结构相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下,![]() 的沸点高于
的沸点高于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
Ⅰ.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
已知:H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1。
(1)ΔH1=________ kJ·mol-1。
(2)有利于提高CH4产率的反应条件是(至少写两条)______________________________工业上提高甲烷反应选择性的关键因素是________________________________。
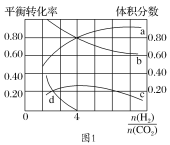
(3)T℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的平衡转化率,则表示H2平衡转化率的是________,c、d分别表示CH4(g)和CO(g)的体积分数,由图1可知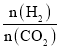 =________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
=________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
Ⅱ.溶于海水的CO2 95%以HCO3-形式存在。
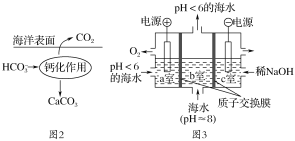
在海洋中,通过图2钙化作用实现碳自净。
(4)写出钙化作用的离子方程式________________。
(5)电解完成后,a室的pH________(填“变大”、“变小”或“几乎不变”);b室发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和结论错误的是( )
A.用新制![]() 悬浊液可鉴别麦芽糖和蔗糖
悬浊液可鉴别麦芽糖和蔗糖
B.用银镜反应可证明淀粉是否水解为葡萄糖,但不能证明其是否完全水解
C.浓硫酸可使蔗糖变黑,证明浓硫酸具有脱水性
D.向蔗糖溶液中滴加几滴稀硫酸后,水浴加热几分钟,将混合液再加入到银氨溶液中,不能发生银镜反应,则证明蔗糖没有发生水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com