
【题目】下表为元素周期表前四周期的一部分,下列有关X、Y、Z、R、W五种元素的叙述中,错误的是
X | ||||
Y | Z | |||
R | W |
A.常压下五种元素的单质中,Y的沸点最高
B.元素电负性:X>Z>Y
C.基态原子中未成对电子数最多的是R
D.元素最高价氧化物对应的水化物酸性:W>Z>Y
【答案】C
【解析】
由图可知,X为O,Y为Si,Z为P,R为Se,W为Br,据此回答。
A.O2或O3,P单质,Se单质,Br2均为分子晶体,Si为原子晶体,所以Si的沸点最高,即常压下五种元素的单质中,Y的沸点最高,A正确;
B.非金属性越强,元素电负性越强,由图可知,非金属性:X>Z>Y,所以元素电负性:X>Z>Y,B正确;
C.几种元素基态原子电子排布图为:O为![]() ,Si为
,Si为![]() ,P为
,P为![]() ,Se为
,Se为![]() ,Br为
,Br为![]() ,由此可知,基态原子中未成对电子数最多的是P元素,即Z,C错误;
,由此可知,基态原子中未成对电子数最多的是P元素,即Z,C错误;
D.H2SiO3是弱酸,H3PO4是中强酸,HBrO4是强酸,酸性HBrO4 >H3PO4 >H2SiO3,即元素最高价氧化物对应的水化物酸性:W>Z>Y,D正确。
答案选C。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图为NaCl和CsCl的晶体结构,下列说法错误的是( )
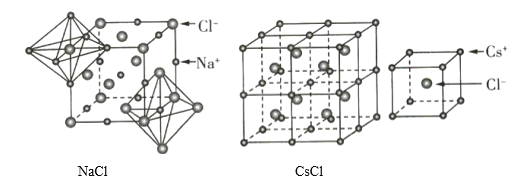
A.NaCl和CsCl都属于AB型的离子晶体
B.NaCl和CsC1晶体中阴、阳离子个数比相同,所以二者的阴、阳离子的配位数也相同
C.CsCl晶体中阴、阳离子的配位数均为8
D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子的半径比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
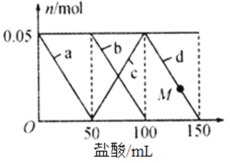
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.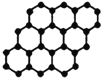 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NA
B. 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元
C. 62gP4含有P-P键的个数为6NA
62gP4含有P-P键的个数为6NA
D. 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是

A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )

A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的应用广泛。试回答下列问题:
(1)基态![]() 原子的价电子轨道表示式为__________,其第一电离能比
原子的价电子轨道表示式为__________,其第一电离能比![]() 的__________(填“大”或“小”)。
的__________(填“大”或“小”)。
(2)氨硼烷(![]() )被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
(3)常温常压下硼酸(![]() )的晶体结构为层状,其二维平面结构如图所示。
)的晶体结构为层状,其二维平面结构如图所示。
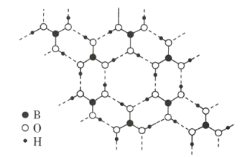
①B原子的杂化方式为__________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: _________________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com