
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如右图. 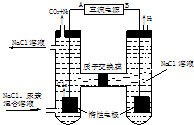
(1)电源的负极为(填“A”或“B”).
(2)阳极室中发生的反应依次为: , .
(3)电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素质量=g(忽略气体的溶解).
【答案】
(1)B
(2)2Cl﹣﹣2e﹣=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
(3)不变;7.2
【解析】解:(1)由图可知,左室电极产物为CO2和N2 , 发生氧化反应,故A为电源的正极,右室电解产物H2 , 发生还原反应,故B为电源的负极,故答案为:B;(2)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl﹣﹣2e﹣═Cl2↑,
CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:2Cl﹣﹣2e﹣=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;(3)阴极反应为6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
电解收集到的13.44 L气体,物质的量为 ![]() =0.6mol,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知n(N2)=n(CO2)=0.6mol×
=0.6mol,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知n(N2)=n(CO2)=0.6mol× ![]() =0.12 mol,
=0.12 mol,
可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 gmol﹣1=7.2 g,
故答案为:不变;7.2.
(1)根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物CO2和N2可以判断出A为电源的正极,B为电源的负极;(2)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;(3)阴极反应为:6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
根据n= ![]() 计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.


科目:高中化学 来源: 题型:
【题目】已知: 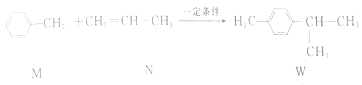 ,
,
下列说法不正确的是( )
A.M的所有原子可能在同一平面上
B.N的二氯代物有5种同分异构体(不考虑立体异构)
C.W的分子式为C10H14
D.M,N和W均能发生氧化反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S、N、Cl都是重要的非金属元素,下列说法正确是( )
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.SO32﹣、ClO﹣、NO3﹣三种离子在溶液中因发生氧化还原反应而不能大量共存
C.浓硫酸、硝酸具有强氧化性,浓硝酸和浓盐酸易分解具有不稳定性
D.标况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA个(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知光气COCl2的分解反应为COCl2(g)Cl2(g)+CO(g)△H=+108kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 
①计算反应在地8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6)v(15﹣16)(填“<”、“>”或“=”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( ) 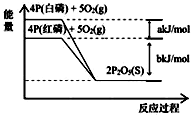
A.4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol
B.4P(红磷)+5O2(g)═2P2O5(S);△H2=﹣(b)kJ/mol
C.4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol
D.P(白磷)═P(红磷);△H4=+(a)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com