
【题目】某科研入员提出 HCHO 与 O2 在羟基磷灰石(HAP)表面催化氧化生成 CO2、H2O 的历程,该历程示意图如下(图中只画出了 HAP 的部分结构)。
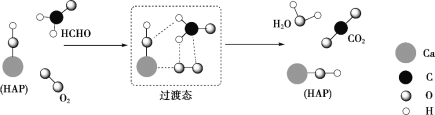
下列说法不正确的是
A.HCHO 在反应过程中,有C—H 键发生断裂
B.HAP 能提高HCHO 与O2 的反应速率和反应物的转化率
C.根据图示信息,CO2 分子中的氧原子并非全部来自 O2
D.该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是
C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是

A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动
C.反应过程中A和B的转化率之比为3:1
D.该条件下此反应的化学平衡常数的数值约为0.91
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2L溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中c(![]() )=0.2mol L-1
)=0.2mol L-1
C.溶液中一定不含![]() 可能含
可能含![]() 和
和![]()
D.三种离子的物质的量之比n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜常用于制船底防污漆。用 CuO 与Cu 高温烧结可制取Cu2O,已知反应:2Cu(s) +O2(g)=2CuO(s)△H= -314kJ/mol;2Cu2O(s)+O2(g)=4CuO(s)△H= -290kJ/mol,则CuOs+Cus=Cu2Os △H 等于
A.-11kJ/molB.-12kJ/molC.+11kJ/molD.-24kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用下图所示的有机物X可生产S﹣诱抗素Y.下列说法不正确的是( )

A.1mol Y与1mol Br2反应的产物有4种
B.1mol Y与足量NaOH溶液反应,最多消耗3mol NaOH
C.1mol X最多能加成7mol H2
D.X可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”)
①升高温度:________;
②增加盐酸体积:____________;
③加入等体积的NaCl溶液:__________;
④滴入几滴CuSO4溶液:____________;
(2)一定温度下,反应N2(g)+O2(g) ===2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”、“减小”或“不变”)
①缩小体积使压强增大:__________;
②恒容充入N2:__________;
③恒压充入He:__________。
(3)可逆反应A(g)+B(g) C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母)
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
①从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。
②该反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com