
【题目】某2L溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中c(![]() )=0.2mol L-1
)=0.2mol L-1
C.溶液中一定不含![]() 可能含
可能含![]() 和
和![]()
D.三种离子的物质的量之比n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
【答案】D
【解析】
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则![]() 和
和![]() 不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在
不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在![]() ,由于溶液中还必须存在阴离子,所以一定还有
,由于溶液中还必须存在阴离子,所以一定还有![]() ,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(
,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(![]() ),据此解答。
),据此解答。
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol0.5mol=0.2mol,则n(![]() )=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol0.1mol=0.4mol,则n(Mg2+)=
)=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol0.1mol=0.4mol,则n(Mg2+)=![]() =0.05mol,
=0.05mol,
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、![]() ,故A错误;
,故A错误;
B.由上述分析可知,溶液中n(![]() )=0.2mol,c(
)=0.2mol,c(![]() )=0.1mol L-1,故B错误;
)=0.1mol L-1,故B错误;
C.由上述分析可知,溶液中一定不含![]() 、
、![]() ,一定含有
,一定含有![]() ,故C错误;
,故C错误;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D正确;
故选:D。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为_________。终点时消耗标准溶液25mL,硝酸银样品纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将A和B各![]() 充入10L的恒容密闭容器中,发生如下反应:
充入10L的恒容密闭容器中,发生如下反应:![]() ;
;![]() 。反应过程中测定的数据如表,则下列说法正确的是
。反应过程中测定的数据如表,则下列说法正确的是
| 0 | 2 | 4 | 7 | 9 |
|
|
|
|
|
|
A.其他条件不变,向平衡体系中再充入![]() A,再达平衡时,B的转化率增大
A,再达平衡时,B的转化率增大
B.其他条件不变,降低温度,反应达到新平衡前v![]() 逆
逆![]()
![]() 正
正![]()
C.其他条件不变,起始时向容器中充入各![]() A和B,平衡时
A和B,平衡时![]()
D.反应前2min的平均速率![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O =Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O =2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(1)Y的化学式为___。
(2)图中X的电子式为___;其水溶液长期在空气中放置容易变浑浊,原因是___(用化学方程式表示);该变化体现出:S非金属性比O___(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,___,得电子能力逐渐减弱。
(3)Z与图表中某物质反应生成SO2的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/LB.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2 ![]() TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
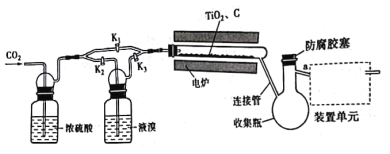
A.开始反应时,活塞的状态为K1关闭,K2,K3打开
B.为防止连接管堵塞,反应过程中需微热连接管
C.为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D.反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研入员提出 HCHO 与 O2 在羟基磷灰石(HAP)表面催化氧化生成 CO2、H2O 的历程,该历程示意图如下(图中只画出了 HAP 的部分结构)。
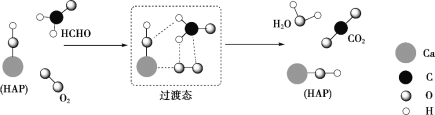
下列说法不正确的是
A.HCHO 在反应过程中,有C—H 键发生断裂
B.HAP 能提高HCHO 与O2 的反应速率和反应物的转化率
C.根据图示信息,CO2 分子中的氧原子并非全部来自 O2
D.该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)仪器A的名称是_____。
(2)A的材质不能用铁质的代替,其原因是:_____。
(3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是:____。实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),若实验操作均正确,则所求中和热___(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_____。
(5)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____(填“有”或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com