
【题目】某温度下,反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/LB.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率D.平衡时CH3OH的转化率小于80%
【答案】B
【解析】
A.由反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误;
CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误;
B.设平衡时转化的浓度为x mol/L,则
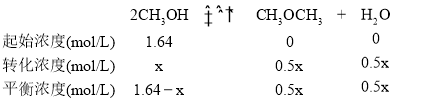
则0.5x×0.5x/(1.64-x)2=400,x=1.6mol/L,平衡时CH3OH的浓度为1.64mol/L-1.6mol/L=0.04mol/L,故B正确;
C.反应到某时刻时浓度商Q=c(H2O)×c(CH3OCH3)/c2(CH3OH)=0.6×0.6/0.442=1.86<400,反应未达到平衡状态,向正反应方向移动,则正反应速率大于逆反应速率,故C错误;
D.平衡时CH3OH的转化率为1.6/1.64×100%=97.6%,故D错误。
故选B。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣![]() 主要成分为
主要成分为![]() ,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
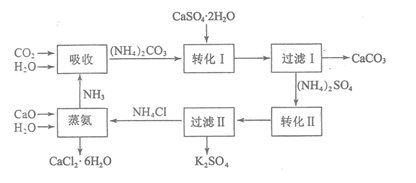
请回答以下问题:
![]() 为了提高原料的利用率,吸收流程中通入
为了提高原料的利用率,吸收流程中通入![]() 和
和![]() 的先后顺序最好为______。
的先后顺序最好为______。
![]() 碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
![]() 工艺流程中除了所给出的
工艺流程中除了所给出的![]() 、
、![]() 、
、![]() 、
、![]() 等原料外,在转化Ⅱ的过程中还需要加入______原料。
等原料外,在转化Ⅱ的过程中还需要加入______原料。
![]() 过滤Ⅱ后所得滤液
过滤Ⅱ后所得滤液![]() 溶液,确认其中含有
溶液,确认其中含有![]() 的方法是:______;
的方法是:______;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,选择的依据是因为______
是目前常用的无机储热材料,选择的依据是因为______![]() 选填序号
选填序号![]() ;
;
A.熔点较低![]() 熔化
熔化![]()
![]() 能导电
能导电![]() 能制冷
能制冷![]() 无毒
无毒
![]() 已知不同温度下
已知不同温度下![]() 在100g水中达到饱和时溶解的量如下表:
在100g水中达到饱和时溶解的量如下表:
温度 | 0 | 20 | 60 |
|
|
|
|
![]() 时
时![]() 的饱和溶液
的饱和溶液![]() 冷却到
冷却到![]() ,可析出
,可析出![]() 晶体______g。
晶体______g。
![]() 上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______
上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______![]() 均填化学式
均填化学式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是

A.O2在b极得电子,最终被还原为![]()
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,![]() 经“交换膜2”移向b极
经“交换膜2”移向b极
D.H2参与的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺![]() 是合成太阳能敏化剂的原料。一定温度下,在三个体积均为
是合成太阳能敏化剂的原料。一定温度下,在三个体积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]() ,测得有关实验数据如表,下列说法正确的是
,测得有关实验数据如表,下列说法正确的是
容器编号 | 温度 | 起始物质的量 | 平衡时物质的量 | ||||
|
|
|
| CH3NH2(g) |
| ||
Ⅰ | 530 |
|
| 0 | 0 |
| |
Ⅱ | 530 |
|
| 0 | 0 | ||
Ⅲ | 500 | 0 | 0 |
|
|
| |
A.达到平衡时,体系中![]() 关系:
关系:![]() ,Ⅰ
,Ⅰ![]() ,Ⅱ
,Ⅱ![]()
B.达到平衡时,转化率:![]() ,Ⅲ
,Ⅲ![]()
C.正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() Ⅲ
Ⅲ![]()
D.530K时,若起始向容器Ⅰ中充入![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() ,则反应将向逆反应方向进行
,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2L溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中c(![]() )=0.2mol L-1
)=0.2mol L-1
C.溶液中一定不含![]() 可能含
可能含![]() 和
和![]()
D.三种离子的物质的量之比n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学学科的一种重要学习手段,硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.(查阅资料)
A.Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
B.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
C.Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.(产品制备)实验装置如图所示(省略夹持装置):

实验步骤:
(1)组装好仪器后,接下来应该进行的实验操作是___,仪器a的名称是___;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
其作用是____。
(2)已知Na2S2O3·5H2O的溶解度随温度升高显著增大,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经___(填操作方法)、冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有___。
Ⅲ.(探究与反思)
(3)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,是否说明一定有Na2SO4___(填“是”或“否”),过滤,向白色沉淀中加入足量稀盐酸,如果产品中含有Na2SO3和Na2SO4,则加入稀盐酸产生的现象是___;
(4)为减少装置C中生成Na2SO4的量,应该先打开___(填“A”或“C”)装置上的活塞。这样做的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜常用于制船底防污漆。用 CuO 与Cu 高温烧结可制取Cu2O,已知反应:2Cu(s) +O2(g)=2CuO(s)△H= -314kJ/mol;2Cu2O(s)+O2(g)=4CuO(s)△H= -290kJ/mol,则CuOs+Cus=Cu2Os △H 等于
A.-11kJ/molB.-12kJ/molC.+11kJ/molD.-24kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在人类活动中占有重要地位。已知反应H2(g) + I2(g)![]() 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:

(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率![]() (HI)=_____kPa·min-1(用含p的式子表示)。
(HI)=_____kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率α(H2)=____________。
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,![]() ________(填“增大”“减小”或“不变”)。
________(填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是__________。
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=________kJmol-1


(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为______________。
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为______膜,C膜为______膜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com