
【题目】实验是化学学科的一种重要学习手段,硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.(查阅资料)
A.Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
B.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
C.Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.(产品制备)实验装置如图所示(省略夹持装置):

实验步骤:
(1)组装好仪器后,接下来应该进行的实验操作是___,仪器a的名称是___;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
其作用是____。
(2)已知Na2S2O3·5H2O的溶解度随温度升高显著增大,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经___(填操作方法)、冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有___。
Ⅲ.(探究与反思)
(3)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,是否说明一定有Na2SO4___(填“是”或“否”),过滤,向白色沉淀中加入足量稀盐酸,如果产品中含有Na2SO3和Na2SO4,则加入稀盐酸产生的现象是___;
(4)为减少装置C中生成Na2SO4的量,应该先打开___(填“A”或“C”)装置上的活塞。这样做的目的是___。
【答案】检查装置气密性 分液漏斗 B 吸收尾气SO2,防止污染环境 蒸发浓缩 玻璃棒、烧杯、漏斗 否 产生无色气体,沉淀部分溶解 A 用A中产生气体排出装置中的空气,减少副反应发生
【解析】
仪器A为制备SO2的装置,因SO2易溶于水,因此利用装置B作安全瓶防止倒吸,然后利用装置C制备Na2S2O3,装置D的作用与B相同,因SO2为污染性气体,因此利用装置E吸收尾气,SO2为酸性氧化物,因此可利用碱液进行吸收。
II.(1)该装置中含有连接装置,因此需要检查装置气密性;仪器a为分液漏斗;由上述分析可知,E中可选择NaOH溶液吸收尾气中SO2,防止污染空气;
(2)由溶液制备晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;过滤时需用到的玻璃仪器为漏斗、烧杯、玻璃棒;
III.(3)因BaSO3、BaSO4都是难溶性物质,因此不能确定该白色沉淀一定为BaSO4,无法确定产品中一定含有Na2SO4;因BaSO3能与盐酸反应生成SO2,而BaSO4不溶于盐酸,因此如果产品中含有Na2SO3和Na2SO4,则加入稀盐酸产生的现象是产生无色气体,沉淀部分溶解;
(4)产生Na2SO4的原因是装置中的氧气将Na2SO3氧化,为减少装置C中生成Na2SO4的量,因此可利用装置中产生的SO2气体将装置中的空气排出,具体操作为打开装置A的活塞。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种盐的溶解度曲线,下列说法正确的是( )

A. 40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体
B. 20℃时,硝酸钾饱和溶液的质量分数是31.6%
C. 60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g硫酸铜晶体
D. 30℃时,将35g硝酸钾和35g 食盐同时溶于100g水中,溶液蒸发时,先析出的是氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式。
①CH3COOH _________ ② NaHSO4 __________________
(2)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=______。若温度不变,滴入稀硫酸使c(H+)=5×10-6 mol/L,则由水电离出的c(H+)为_______ 。
(3)常温下,浓度均为0.01 mol/L 的两瓶溶液盐酸和氢氟酸,升高相同的温度,c(Cl-)/ c(F-)的值__________(填“变大”“变小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/LB.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
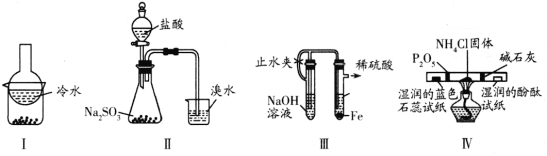
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或分子结构模型表示正确的是
A.中子数为146、质子数为92的铀(U)原子![]()
B.四氯甲烷的球棍模型:![]()
C.乙烷的结构简式:CH3CH3
D.HClO的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明醋酸是弱电解质的是 ( )
A. 醋酸能使石蕊溶液变红
B. ![]() 时.
时.![]() 醋酸的pH约为3
醋酸的pH约为3
C. 向醋酸中加入氢氧化钠溶液,溶液pH增大
D. 醋酸能与碳酸钙反应产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯、溶液的配制和分析是化学家常用的研究物质的实验方法,根据所学知识,回答下列问题:
Ⅰ.实验室从海藻中提取碘的流程如图:

(1)提取碘的过程中,操作③的名称为___。
(2)“后期处理”中涉及的操作为___。
(3)在灼烧过程中,使用到的实验仪器有___(除三脚架和酒精灯外)。
A.烧杯 B.蒸发皿 C.坩埚钳 D.瓷坩埚 E.泥三角
Ⅱ.依据粗盐提纯的原理,除去硝酸钾固体中少量的硝酸镁、硫酸镁杂质,按如图步骤操作,回答下列问题:

(1)试剂A和B的化学式分别是___,___。
(2)操作Ⅱ为___,___,___。
Ⅲ.实验室现需配制物质的量浓度为1mol/L的NaOH溶液480mL。
(1)实验过程中用到的玻璃仪器有:烧杯、玻璃棒、___、___。
(2)要配制此溶液,需要称量NaOH固体的质量为___。
(3)下列操作会使所配溶液浓度偏大的有___。
A.溶解固体溶质时,未冷却到室温即转入容量瓶定容
B.容量瓶中原有少量蒸馏水
C.定容时仰视读数
D.砝码生锈但未脱落
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com