
ΓΨΧβΡΩΓΩΒβΦΑΤδΜ·ΚœΈο‘Ύ»ΥάύΜνΕ·÷–’Φ”–÷Ί“ΣΒΊΈΜΓΘ“―÷ΣΖ¥”ΠH2(g) + I2(g)![]() 2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1ΓΘ716K ±Θ§‘Ύ“ΜΟή±’»ίΤς÷–Α¥Έο÷ ΒΡΝΩ±»1:1≥δ»κH2(g)ΚΆI2(g)Θ§≤βΒΟΤχΧεΜλΚœΈο÷–ΒβΜ·«βΒΡΈο÷ ΒΡΝΩΖ÷ ΐ”κΖ¥”Π ±ΦδΒΡΙΊœΒ»γœ¬ΆΦΘΚ
2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1ΓΘ716K ±Θ§‘Ύ“ΜΟή±’»ίΤς÷–Α¥Έο÷ ΒΡΝΩ±»1:1≥δ»κH2(g)ΚΆI2(g)Θ§≤βΒΟΤχΧεΜλΚœΈο÷–ΒβΜ·«βΒΡΈο÷ ΒΡΝΩΖ÷ ΐ”κΖ¥”Π ±ΦδΒΡΙΊœΒ»γœ¬ΆΦΘΚ

(1)»τΖ¥”ΠΩΣ Φ ±ΤχΧεΜλΚœΈοΒΡΉή―ΙΈΣp kPaΘ§‘ρΖ¥”Π‘Ύ«Α20 minΡΎΒΡΤΫΨυΥΌ¬ ![]() (HI)=_____kPaΓΛminΘ≠1(”ΟΚ§pΒΡ ΫΉ”±μ Ψ)ΓΘ
(HI)=_____kPaΓΛminΘ≠1(”ΟΚ§pΒΡ ΫΉ”±μ Ψ)ΓΘ
(2)Ζ¥”Π¥οΤΫΚβ ±Θ§H2ΒΡΉΣΜ·¬ ΠΝ(H2)=____________ΓΘ
(3)…œ ωΖ¥”Π÷–Θ§’ΐΖ¥”ΠΥΌ¬ ΈΣv’ΐ= k’ΐΓΛc(H2)ΓΛc(I2)Θ§ΡφΖ¥”ΠΥΌ¬ ΈΣvΡφ=kΡφΓΛc2(HI)Θ§Τδ÷–k’ΐΓΔkΡφΈΣΥΌ¬ ≥Θ ΐΓΘ…ΐΗΏΈ¬Ε»Θ§![]() ________(ΧνΓΑ‘ω¥σΓ±ΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ
________(ΧνΓΑ‘ω¥σΓ±ΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ
(4)ΫΒΒΆΈ¬Ε»Θ§ΤΫΚβΩ…ΡήΡφœρ“ΤΕ·ΒΡ‘≠“ρ «__________ΓΘ
(5)1 mol H2(g)Ζ÷Ή”÷–Μ·―ßΦϋΕœΝ― ±–η“ΣΈϋ ’436 kJΒΡΡήΝΩΘ§œ¬ΆΦ÷–ΒΡΠΛH2=________kJmolΘ≠1


(6)«βΒβΥαΩ…”ΟΓΑΥΡ “ ΫΒγ…χΈωΖ®Γ±÷Τ±ΗΘ§ΒγΫβΉΑ÷ΟΦΑΤπ ΦΒΡΒγΫβ÷ »ή“Κ»γ…œΆΦΥυ ΨΓΘ
ΔΌ―τΦΪΒγΦΪΖ¥”Π ΫΈΣ______________ΓΘ
ΔΎ―τΡΛΚΆ“θΡΛΖ÷±π÷Μ‘ –μ―τάκΉ”ΓΔ“θάκΉ”Ά®ΙΐΘ§AΡΛΈΣ―τΡΛΘ§‘ρBΡΛΈΣ______ΡΛΘ§CΡΛΈΣ______ΡΛΓΘ
ΓΨ¥πΑΗΓΩ0.03 p 78.4% Φθ–Γ ΫΒΈ¬ ΙΒβ’τΤχ±δΈΣΙΧΧ§Θ§ΤχΧ§Ββ≈®Ε»ΫΒΒΆΤΫΚβΡφœρ“ΤΕ· Θ≠162 2H2OΘ≠4eΘ≠===4HΘΪΘΪO2Γϋ “θ ―τ
ΓΨΫβΈωΓΩ
Θ®1Θ©Ν–≥ω»ΐΕΈ ΫΘ§ΗυΨίΥΌ¬ ΙΪ ΫΦΤΥψΘΜ
Θ®2Θ©ΗυΨίΉΣΜ·¬ ΙΪ ΫΦΤΥψΘΜ
Θ®3Θ©ΒΫ¥οΤΫΚβ ±Θ§’ΐΓΔΡφΖ¥”ΠΥΌ¬ œύΒ»Θ§![]() Φ¥Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐΘ§H2(g) + I2(g)
Φ¥Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐΘ§H2(g) + I2(g)![]() 2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§
2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§![]() Φθ–ΓΘΜ
Φθ–ΓΘΜ
Θ®4Θ©ΫΒΒΆΈ¬Ε»Θ§ΤΫΚβΩ…ΡήΡφœρ“ΤΕ·ΒΡ‘≠“ρ «ΘΚΫΒΈ¬ ΙΒβ’τΤχ±δΈΣΙΧΧ§ΘΜ
Θ®5Θ©”…ΆΦΗυΨίΗ«ΥΙΕ®¬…ΦΤΥψΘΜ
Θ®6Θ©ΔΌΥ°‘Ύ―τΦΪΖΔ…ζ―θΜ·Ζ¥”Π…ζ≥…―θΤχΘΜ
ΔΎ―τΡΛΚΆ“θΡΛΖ÷±π÷Μ‘ –μ―τάκΉ”ΓΔ“θάκΉ”Ά®ΙΐΘ§AΡΛΈΣ―τΡΛ‘ –μ«βάκΉ”Ά®ΙΐΘ§‘ρBΡΛΈΣ“θΡΛΘ§‘ –μΒβάκΉ”Ά®ΙΐΘ§CΡΛΈΣ―τΡΛΘ§‘ –μΡΤάκΉ”Ά®ΙΐΓΘ
Θ®1Θ©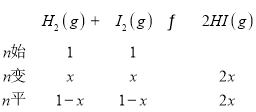
”…ΆΦ![]() Θ§x=0.6Θ§
Θ§x=0.6Θ§
![]() (HI)=
(HI)=![]() ==0.03pkPaΓΛminΘ≠1
==0.03pkPaΓΛminΘ≠1
Θ®2Θ©Ζ¥”Π¥οΤΫΚβ ±Θ§HIΒΡΧεΜΐΖ÷ ΐΈΣ0.784Θ§![]() Θ§x=0.784Θ§H2ΒΡΉΣΜ·¬ ΠΝ(H2)=
Θ§x=0.784Θ§H2ΒΡΉΣΜ·¬ ΠΝ(H2)=![]() =78.4%ΘΜ
=78.4%ΘΜ
Θ®3Θ©ΒΫ¥οΤΫΚβ ±Θ§’ΐΓΔΡφΖ¥”ΠΥΌ¬ œύΒ»Θ§’ΐΖ¥”ΠΥΌ¬ ΈΣv’ΐ= k’ΐΓΛc(H2)ΓΛc(I2)Θ§ΡφΖ¥”ΠΥΌ¬ ΈΣvΡφ=kΡφΓΛc2(HI)Θ§v’ΐ= k’ΐΓΛc(H2)ΓΛc(I2)=kΡφΓΛc2(HI)=vΡφΘ§![]() =
=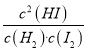 =KȧH2(g) + I2(g)
=KΘ§H2(g) + I2(g)![]() 2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§
2HI(g) ΠΛH=©¹11 kJΓΛmolΘ≠1Θ§…ΐΗΏΈ¬Ε»Θ§ΤΫΚβΡφœρ“ΤΕ·Θ§![]() Φθ–ΓΘΜ
Φθ–ΓΘΜ
Θ®4Θ©ΫΒΒΆΈ¬Ε»Θ§ΤΫΚβΩ…ΡήΡφœρ“ΤΕ·ΒΡ‘≠“ρ «ΘΚΫΒΈ¬ ΙΒβ’τΤχ±δΈΣΙΧΧ§Θ§ΤχΧ§Ββ≈®Ε»ΫΒΒΆΤΫΚβΡφœρ“ΤΕ·ΓΘ
Θ®5Θ©1 mol H2(g)Ζ÷Ή”÷–Μ·―ßΦϋΕœΝ― ±–η“ΣΈϋ ’436 kJΒΡΡήΝΩΘ§”…ΆΦΠΛH3=587kJmolΘ≠1Θ§1 mol I2(g)Ζ÷Ή”÷–Μ·―ßΦϋΕœΝ― ±–η“ΣΈϋ ’587KJ-436 kJ=151KJΒΡΡήΝΩΘ§Φ¥ΠΛH2=151kJmolΘ≠1Θ§”÷ΠΛH1+ΠΛH2=ΠΛHΘ§ΠΛH2=ΠΛH-ΠΛH1=Θ®-11-151Θ©kJmolΘ≠1=-162kJmolΘ≠1ΘΜ
Θ®6Θ©ΔΌΥ°‘Ύ―τΦΪΖΔ…ζ―θΜ·Ζ¥”Π…ζ≥…―θΤχΘ§―τΦΪΒγΦΪΖ¥”Π ΫΈΣ2H2OΘ≠4eΘ≠===4HΘΪΘΪO2ΓϋΓΘ
ΔΎ―τΡΛΚΆ“θΡΛΖ÷±π÷Μ‘ –μ―τάκΉ”ΓΔ“θάκΉ”Ά®ΙΐΘ§AΡΛΈΣ―τΡΛ‘ –μ«βάκΉ”Ά®ΙΐΘ§‘ρBΡΛΈΣ“θΡΛΘ§‘ –μΒβάκΉ”Ά®ΙΐΘ§CΡΛΈΣ―τΡΛΘ§‘ –μΡΤάκΉ”Ά®ΙΐΓΘ


 ΩλΫί”Δ”ο÷ή÷ήΝΖœΒΝ–¥πΑΗ
ΩλΫί”Δ”ο÷ή÷ήΝΖœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬Θ§Ζ¥”Π2CH3OH(g)![]() CH3OCH3(g) + H2O(g)ΒΡΤΫΚβ≥Θ ΐΈΣ400ΓΘ¥ΥΈ¬Ε»œ¬Θ§‘Ύ»ίΜΐ“ΜΕ®ΒΡΟή±’»ίΤς÷–Φ”»κCH3OHΘ§Ζ¥”ΠΒΫΡ≥ ±ΩΧ≤βΒΟΗςΉιΖ÷ΒΡ≈®Ε»ΈΣ±μ÷–œύ”ΠΒΡ ΐΨίΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
CH3OCH3(g) + H2O(g)ΒΡΤΫΚβ≥Θ ΐΈΣ400ΓΘ¥ΥΈ¬Ε»œ¬Θ§‘Ύ»ίΜΐ“ΜΕ®ΒΡΟή±’»ίΤς÷–Φ”»κCH3OHΘ§Ζ¥”ΠΒΫΡ≥ ±ΩΧ≤βΒΟΗςΉιΖ÷ΒΡ≈®Ε»ΈΣ±μ÷–œύ”ΠΒΡ ΐΨίΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
Έο÷ | CH3OH | CH3OCH3 | H2O |
≈®Ε»/Θ®molΓΛL-1Θ© | 0.44 | 0.6 | 0.6 |
A.CH3OHΒΡΤπ Φ≈®Ε»ΈΣ1.04 mol/LB.ΤΫΚβ ±CH3OHΒΡ≈®Ε»ΈΣ0.04 mol/L
C.¥Υ ±ΡφΖ¥”ΠΥΌ¬ ¥σ”Ύ’ΐΖ¥”ΠΥΌ¬ D.ΤΫΚβ ±CH3OHΒΡΉΣΜ·¬ –Γ”Ύ80%
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΊ”Ύ0.1mol/LNa2CO3 »ή“ΚΘ§œ¬Ν–≈–Εœ≤Μ’ΐ»ΖΒΡ «
A.ΝΘΉ”÷÷άύ”κNaHCO3 »ή“Κ≤ΜΆ§B.…ΐΗΏΈ¬Ε»Θ§c![]() Φθ–Γ
Φθ–Γ
C.Φ”»κCa(OH)2»ή“ΚΘ§c![]() Φθ–ΓD.cH+ +cNa+ =2c
Φθ–ΓD.cH+ +cNa+ =2c![]() +c
+c![]() +cOH-
+cOH-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“Μ÷÷»έ»ΎΧΦΥα―Έ»ΦΝœΒγ≥Ί‘≠άμ Ψ“βΆΦ»γœ¬ΓΘœ¬Ν–”–ΙΊΗΟΒγ≥ΊΒΡΥΒΖ®’ΐ»ΖΒΡ «(ΓΓΓΓ)
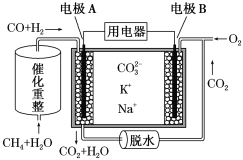
A.Βγ≥ΊΙΛΉς ±Θ§CO32-œρΒγΦΪB“ΤΕ·
B.ΒγΦΪB…œΖΔ…ζΒΡΒγΦΪΖ¥”ΠΈΣO2ΘΪ2CO2ΘΪ4eΘ≠=2 CO32-
C.ΒγΦΪA…œH2≤Έ”κΒΡΒγΦΪΖ¥”ΠΈΣH2ΘΪ2OHΘ≠Θ≠2eΘ≠=2H2O
D.Ζ¥”ΠCH4ΘΪH2O 3H2ΘΪCOΘ§ΟΩœϊΚΡ1 mol CH4ΉΣ“Τ12 molΒγΉ”
3H2ΘΪCOΘ§ΟΩœϊΚΡ1 mol CH4ΉΣ“Τ12 molΒγΉ”
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”Ο50mL0.50molΓΛLΘ≠1ΒΡ―ΈΥα”κ50mL0.55molΓΛLΘ≠1ΒΡ«β―θΜ·ΡΤ»ή“Κ‘Ύ»γΆΦΥυ ΨΒΡΉΑ÷Ο÷–Ϋχ––÷–ΚΆΖ¥”ΠΘ§Ά®Ιΐ≤βΕ®Ζ¥”ΠΙΐ≥Χ÷–ΥυΖ≈≥ωΒΡ»»ΝΩΩ…ΦΤΥψ÷–ΚΆ»»ΓΘΜΊ¥πœ¬Ν–Έ ΧβΓΘ

(1)“«ΤςAΒΡΟϊ≥Τ «_____ΓΘ
(2)AΒΡ≤Ρ÷ ≤ΜΡή”ΟΧζ÷ ΒΡ¥ζΧφΘ§Τδ‘≠“ρ «ΘΚ_____ΓΘ
(3) Β―ι ±«β―θΜ·ΡΤ»ή“ΚΒΡ≈®Ε»“Σ”Ο0.55molΓΛLΘ≠1ΒΡ‘≠“ρ «ΘΚ____ΓΘ Β―ι÷–»τΗΡ”Ο60mL0.5molΓΛLΘ≠1ΒΡ―ΈΥα”κ50mL0.55molΓΛLΘ≠1ΒΡ«β―θΜ·ΡΤ»ή“ΚΫχ––Ζ¥”ΠΘ§”κ…œ ω Β―ιœύ±»Θ§ΥυΖ≈≥ωΒΡ»»ΝΩ____(ΧνΓΑœύȖΜρΓΑ≤ΜœύȖ)Θ§»τ Β―ι≤ΌΉςΨυ’ΐ»ΖΘ§‘ρΥυ«σ÷–ΚΆ»»___(ΧνΓΑœύȖΜρΓΑ≤ΜœύȖ)ΘΜ
(4)“―÷Σ‘ΎœΓ»ή“Κ÷–Θ§«ΩΥαΚΆ«ΩΦνΖΔ…ζ÷–ΚΆΖ¥”Π…ζ≥…1molH2O ±Θ§Ζ≈≥ω57.3kJΒΡ»»ΝΩΘ§‘ρ…œ ωΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ_____ΓΘ
(5)»τ”ΟKOH¥ζΧφNaOHΘ§Ε‘≤βΕ®ΫαΙϊ____(ΧνΓΑ”–Γ±ΜρΓΑΈόΓ±)”ΑœλΘΜ»τ”Ο¥ΉΥα¥ζΧφHClΉω Β―ιΘ§Ε‘≤βΕ®ΫαΙϊ_____(ΧνΓΑ”–Γ±ΜρΓΑΈόΓ±)”ΑœλΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖ÷άκΧα¥ΩΓΔ»ή“ΚΒΡ≈δ÷ΤΚΆΖ÷Έω «Μ·―ßΦ“≥Θ”ΟΒΡ―–ΨΩΈο÷ ΒΡ Β―ιΖΫΖ®Θ§ΗυΨίΥυ―ß÷Σ ΕΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Δώ. Β―ι “¥”ΚΘ‘ε÷–Χα»ΓΒβΒΡΝς≥Χ»γΆΦΘΚ

Θ®1Θ©Χα»ΓΒβΒΡΙΐ≥Χ÷–Θ§≤ΌΉςΔέΒΡΟϊ≥ΤΈΣ___ΓΘ
Θ®2Θ©ΓΑΚσΤΎ¥ΠάμΓ±÷–…φΦΑΒΡ≤ΌΉςΈΣ___ΓΘ
Θ®3Θ©‘ΎΉΤ…’Ιΐ≥Χ÷–Θ§ Ι”ΟΒΫΒΡ Β―ι“«Τς”–___Θ®≥ΐ»ΐΫ≈ΦήΚΆΨΤΨΪΒΤΆβΘ©ΓΘ
A.…’±≠ B.’τΖΔΟσ C.έαέω«· D.¥…έαέω E.Ρύ»ΐΫ«
Δρ.“άΨί¥÷―ΈΧα¥ΩΒΡ‘≠άμΘ§≥ΐ»ΞœθΥαΦΊΙΧΧε÷–…ΌΝΩΒΡœθΥαΟΨΓΔΝρΥαΟΨ‘”÷ Θ§Α¥»γΆΦ≤Ϋ÷η≤ΌΉςΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ

Θ®1Θ© ‘ΦΝAΚΆBΒΡΜ·―ß ΫΖ÷±π «___Θ§___ΓΘ
Θ®2Θ©≤ΌΉςΔρΈΣ___Θ§___Θ§___ΓΘ
Δσ. Β―ι “œ÷–η≈δ÷ΤΈο÷ ΒΡΝΩ≈®Ε»ΈΣ1mol/LΒΡNaOH»ή“Κ480mLΓΘ
Θ®1Θ© Β―ιΙΐ≥Χ÷–”ΟΒΫΒΡ≤ΘΝß“«Τς”–ΘΚ…’±≠ΓΔ≤ΘΝßΑτΓΔ___ΓΔ___ΓΘ
Θ®2Θ©“Σ≈δ÷Τ¥Υ»ή“ΚΘ§–η“Σ≥ΤΝΩNaOHΙΧΧεΒΡ÷ ΝΩΈΣ___ΓΘ
Θ®3Θ©œ¬Ν–≤ΌΉςΜα ΙΥυ≈δ»ή“Κ≈®Ε»ΤΪ¥σΒΡ”–___ΓΘ
A.»ήΫβΙΧΧε»ή÷ ±Θ§Έ¥ά以ΒΫ “Έ¬Φ¥ΉΣ»κ»ίΝΩΤΩΕ®»ί
B.»ίΝΩΤΩ÷–‘≠”–…ΌΝΩ’τΝσΥ°
C.Ε®»ί ±―ω ”ΕΝ ΐ
D.μά¬κ…ζ–βΒΪΈ¥Ά―¬δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬ ±Θ§”Ο![]() ΒΈΕ®
ΒΈΕ®![]() Ρ≥“Μ‘ΣΥαHX,ΒΈΕ®Ιΐ≥Χ÷–pH±δΜ·«ζœΏ»γΆΦΥυ ΨΓΘ
Ρ≥“Μ‘ΣΥαHX,ΒΈΕ®Ιΐ≥Χ÷–pH±δΜ·«ζœΏ»γΆΦΥυ ΨΓΘ

œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. HX»ή“Κœ‘Υα–‘ΒΡ‘≠“ρ «![]()
B. ΒψaΘ§![]()
C. ΒψbΘ§![]() ”κ
”κ![]() «ΓΚΟΆξ»ΪΖ¥”Π
«ΓΚΟΆξ»ΪΖ¥”Π
D. ΒψcΘ§![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤ίΥα «“Μ÷÷Εΰ‘Σ»θΥαΘ§Ω…”ΟΉςΜΙ‘≠ΦΝΓΔ≥ΝΒμΦΝΒ»ΓΘΡ≥–ΘΩΈΆβ–ΓΉφΒΡΆ§―ß…ηΦΤάϊ”ΟC2H2ΤχΧε÷Τ»ΓH2C2O42H2OΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΦΉΉιΒΡΆ§―ß“‘Βγ ·Θ®÷ς“Σ≥…Ζ÷CaC2Θ§…ΌΝΩCaSΦΑCa3P2‘”÷ Β»Θ©ΈΣ‘≠ΝœΘ§≤Δ”Ο»γΆΦΉΑ÷Ο÷Τ»ΓC2H2ΓΘ

ΔΌΒγ ·”κΥ°Ζ¥”ΠΚήΩλΘ§ΈΣΝΥΦθΜΚΖ¥”ΠΥΌ¬ Θ§ΉΑ÷ΟA÷–≥ΐ”Ο±ΞΚΆ ≥―ΈΥ°¥ζΧφΥ°÷°ΆβΘ§ΜΙΩ…“‘≤…»ΓΒΡ¥κ © «____________________________ Θ®–¥“Μ÷÷Φ¥Ω…Θ©ΓΘ
ΔΎΉΑ÷ΟB÷–Θ§NaClOΫΪH2SΓΔPH3 ―θΜ·ΈΣΝρΥαΦΑΝΉΥαΘ§±Ψ…μ±ΜΜΙ‘≠ΈΣNaClΘ§Τδ÷–PH3±Μ―θΜ·ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________________________ΓΘ
Θ®2Θ©““ΉιΒΡΆ§―ßΗυΨίΈΡœΉΉ ΝœΘ§”ΟHg(NO3)2Ής¥ΏΜ·ΦΝΘ§≈®œθΥα―θΜ·C2H2÷Τ»ΓH2C2O4ΓΛ2H2OΓΘ÷Τ±ΗΉΑ÷Ο»γΆΦΥυ ΨΘΚ

ΔΌΉΑ÷ΟD÷–ΕύΩΉ«ρ≈ίΒΡΉς”Ο «______________________ΓΘ
ΔΎΉΑ÷ΟD÷–…ζ≥…H2C2O4ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___________________________________ΓΘ
Δέ¥”ΉΑ÷ΟD÷–ΒΟΒΫ≤ζΤΖΘ§ΜΙ–ηΨ≠Ιΐ__________________Θ®Χν≤ΌΉςΟϊ≥ΤΘ©ΓΔΙΐ¬ΥΓΔœ¥Β”ΦΑΗ…‘οΓΘ
Θ®3Θ©±ϊΉι…ηΦΤΝΥ≤βΕ®““Ήι≤ζΤΖ÷–H2C2O4ΓΛ2H2OΒΡ÷ ΝΩΖ÷ ΐ Β―ιΓΘΥϊΟ«ΒΡ Β―ι≤Ϋ÷η»γœ¬ΘΚΉΦ»Ζ≥Τ»Γm g≤ζΤΖ”ΎΉΕ–ΈΤΩ÷–Θ§Φ”»κ ΝΩΒΡ’τΝσΥ°»ήΫβΘ§‘ΌΦ”»κ…ΌΝΩœΓΝρΥαΘ§»ΜΚσ”Οc mol/LΥα–‘KMnO4±ξΉΦ»ή“ΚΫχ––ΒΈΕ®÷Ν÷’ΒψΘ§Ι≤œϊΚΡ±ξΉΦ»ή“ΚV mLΓΘ
ΔΌΒΈΕ® ±ΗΏΟΧΥαΦΊ±ξΉΦ»ή“Κ ΔΖ≈‘ΎΒΈΕ®Ιή÷–_____________Θ®ΧνΓΑΥα ΫΓ±ΜρΓΑΦν ΫΓ±Θ©ΓΘ
ΔΎΒΈΕ®Ιΐ≥Χ÷–ΖΔœ÷Ά …ΪΥΌ¬ ΩΣ ΦΚή¬ΐΚσ÷πΫΞΦ”ΩλΘ§Ζ÷ΈωΩ…ΡήΒΡ‘≠“ρ «______________ ΓΘ
Δέ≤ζΤΖ÷–H2C2O4ΓΛ2H2OΒΡ÷ ΝΩΖ÷ ΐΈΣ_________________Θ®Ν–≥ωΚ§ mΓΔcΓΔV ΒΡ±μ¥ο ΫΘ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœύΆ§Έ¬Ε»ΓΔœύΆ§≈®Ε»ΒΡΝυ÷÷»ή“ΚΘ§ΤδpH”…–ΓΒΫ¥σΒΡΥ≥–ρ»γΆΦΥυ ΨΘ§ΆΦ÷–ΔΌΔΎΔέ¥ζ±μΒΡΈο÷ Ω…ΡήΖ÷±π «
![]()
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com